Презентация на тему: углерод

Углерод Гончаров Никита 9 «Г» класс

Строение атома

Порядковый номер – 6 Строение атома: протонов – 6, нейтронов – 6, электронов – 6 Энергетических уровней – 2 Число электронов на последнем уровне – 4 Максимальная степень окисления + 4 Минимальная степень окисления -4

аллотропия Углерод образует аллотропные модификации : алмаз, графит,фуллерен. Причина этого явления состоит в разном строении кристаллических решеток . алмаз имеет объемную тетраэдрическую атомную решетку; графит – плоскостную атомную кристаллическую решетку; фуллерен – сферическую.

Алмаз Алмаз - прозрачное, бесцветное вещество с сильной лучепреломляемостью. Обладает твердостью, превосходящей твердость всех известных в природе веществ. Химически очень устойчивое вещество.

Лавуазье поставил опыт по сжиганию алмаза, используя собранную специально для этой цели зажигательную машину. Оказалось, алмаз сгорает на воздухе при температуре 7000С, не оставляя твердого остатка, как и обычный уголь. В структуре алмаза каждый атом углерода имеет четырех соседей, которые расположены от него на равных расстояниях в вершинах тетраэдра. Весь кристалл представляет собой единый трехмерный каркас. С этим связаны многие свойства алмаза, в частности его самая высокая среди минералов твердость. Кристаллы алмаза, особенно ограненные (бриллианты), очень сильно преломляют свет.


Графит Графит- вещество серо – стального цвета, мягок, жирен на ощупь. Является хорошим проводником электричества. Имеет слоистую структуру.

Графит представляет собой темно-серое с металлическим блеском, мягкое, жирное на ощупь вещество. Хорошо проводит электрический ток. Графит широко применяется в технике. Графитовый порошок используют для изготовления минеральных красок, а также в качестве смазочного материала – между отдельными слоями графита взаимодействие настолько слабое, что возникает скольжение. Графитовые стержни служат электродами во многих электрохимических процессах; из смеси графита с глиной изготавливают тигли для плавки металлов. Блоки из особо чистого графита являются основным материалом для создания атомных реакторов.

Фуллерен В 1992 году фуллерены обнаружены в природе – в минерале шунгите (аморфном углероде), названном в честь поселка Шуньга в Карелии. Неудивительно, что долгое время примесь фуллерена в шунгите не замечали: его там лишь около 0,001%.

Усилия многих ученых – физиков, химиков, материаловедов – направлены на развитие нанотехнологии – технологических процессов, осуществляемых на молекулярном уровне. В 1991 году японские ученые на стенках прибора, в котором проводили синтез фуллеренов, обнаружили наночастицы углерода – полые углеродные трубки диаметром 3-10 нм, их стенки состоят всего из нескольких слоев атомов. С одной стороны каждая такая трубка закрывается «крышкой», которая является не чем иным, как фрагментом структуры фуллерена.
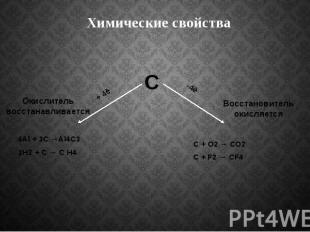
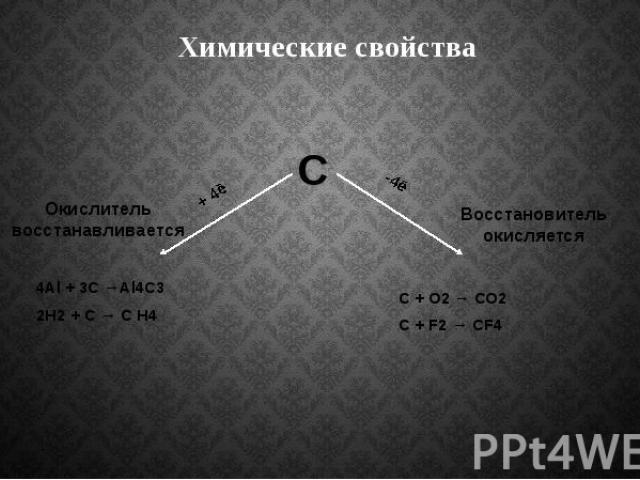
Химические свойства

В нормальных условиях углерод химически малоактивен, однако при высокой температуре он реагирует со многими веществами. Самой активной формой является аморфный углерод, менее активен графит, самый инертный – алмаз. При нагревании углерод соединяются с кислородом, образуя оксид углерода (IV), или углекислый газ: С + O2 = CO2 При недостатке кислорода образуется оксид углерода (II), или угарный газ: 2С + О2 = 2СО

С водородом углерод соединяется только при высоких температурах и в присутствии катализаторов. В зависимости от температуры образуются различные углеводороды, например, метан: С + 2H2 = CH4 Углерод взаимодействует при нагревании с серой и фтором, в электрической дуге с азотом: С + 2S = CS2 С + 2F2 = CF4 2С + N2 = (CN)2

Углерод – сильный восстановитель. При нагревании с водяным паром он вытесняет из воды водород: Н2O + С = СО + Н2 При нагревании углерода с оксидом углерода (IV) образуется угарный газ: С + СО2 = 2СО Углерод восстанавливает многие металлы из их оксидов: 2Fe2O3 + 3С = 4Fe + 3CO2

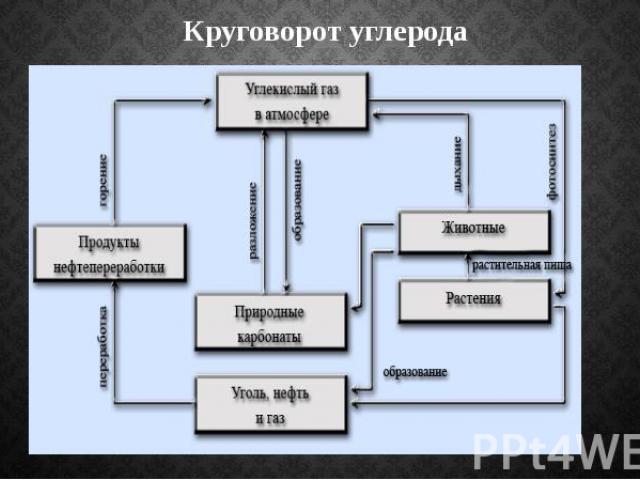
Биологическое значение Углерод является основой всех органических веществ. Любой живой организм состоит в значительной степени из углерода. Углерод — основа жизни. Источником углерода для живых организмов обычно является СО2 из атмосферы или воды. В результате фотосинтеза он попадает в биологические пищевые цепи, в которых живые существа поедают друг друга или останки друг друга и тем самым добывают углерод для строительства собственного тела. Биологический цикл углерода заканчивается либо окислением и возвращением в атмосферу, либо захоронением в виде угля или нефти.
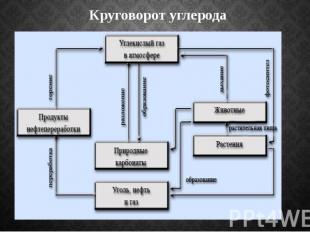
Круговорот углерода

Лирическое отступление

Спасибо за внимание!!!