Презентация на тему: Углерод (9 класс)

Урок :Углерод (9 класс)Автор:Ахметвалиева НаиляМисбаховна , учитель химии ГБОУ ООШ п.Приморский м.р.Ставропольский Самарской области УглеродУглерод — химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Менделеева, порядковый номер 6, атомная масса — 12,0107. Символ: CАтомный номер: 6Электронная конфигурация: [He] 2s2 2p2Открытие: 3750 г. до н.э.Температура кипения: 4 827°CАтомная масса: 12,0107 ± 0,0008 а. е. м.

Строение и свойства атомов Углерод С –первый элемент главной подгруппы IV группы Периодической системы. Степень окисления -4 ,+4
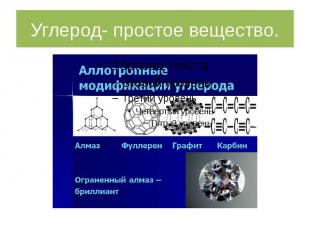
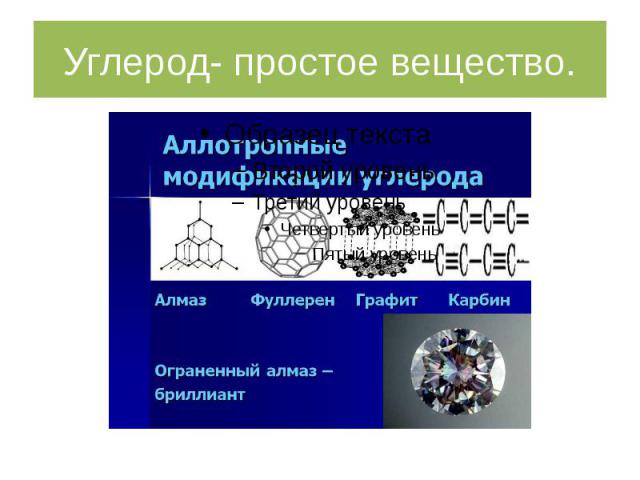
Углерод- простое вещество.

Химические свойства углерода Уникальная способность атомов Углерода соединяться между собой с образованием прочных и длинных цепей и циклов привела к возникновению громадного числа разнообразных соединений Углерода, изучаемых органической химией.В соединениях Углерод проявляет степени окисления -4; +2; +4. Атомный радиус 0,77Å, ковалентные радиусы 0,77Å, 0,67Å, 0,60Å соответственно в одинарной, двойной и тройной связях; ионный радиус С4-2,60Å, С4+ 0,20Å. При обычных условиях Углерод химически инертен, при высоких температурах он соединяется со многими элементами, проявляя сильные восстановительные свойства. Химическая активность убывает в ряду: "аморфный" Углерод, графит, алмаз; взаимодействие с кислородом воздуха (горение) происходит соответственно при температурах выше 300-500 °С, 600-700 °С и 850-1000 °С с образованием оксида углерода (IV) СО2 и оксида углерода (II) СО.

Химические свойства углерода Химические свойства. Углерод в свободном состоянии является типичным восстановителем. При окислении кислородом в избытке воздуха он превращается в оксид углерода (IV):при недостатке - в оксид углерода (II):Обе реакции сильно экзотермичны.При нагревании углерода в атмосфере оксида углерода (IV) образуется угарный газ:Углерод восстанавливает многие металлы из их оксидов:Так протекают реакции с оксидами кадмия, меди, свинца. При взаимодействии углерода с оксидами щелочноземельных металлов, алюминия и некоторых других металлов

Соединения углерода Углерод образует два оксида- СО и СО2Оксид углерода (II) CO –бесцветный ,не имеющий запаха газ, малорастворимый в воде. При вдыхании 0,1% воздуха, содержащего СО человек может потерять сознание и умереть.Оксид углерода (IV) CO2-углекислый газ , бесцветный ,не имеющий запаха газ.

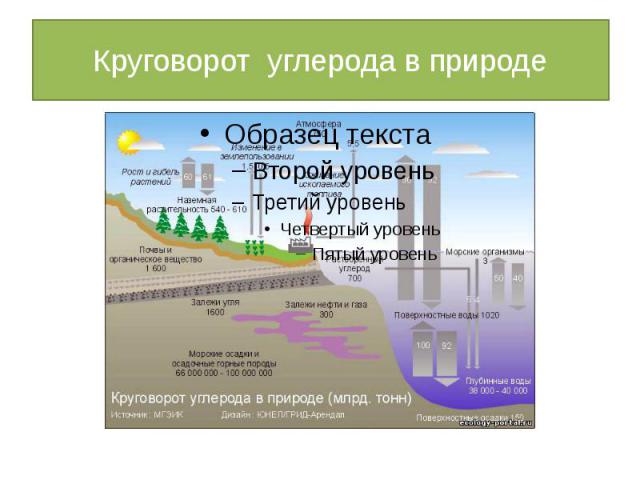
Круговорот углерода в природе