Презентация на тему: Гидролиз неорганических веществ

Презентация к уроку химии по теме «Гидролиз неорганических веществ - солей». 11 класс. УМК Габриеляна О.С. Базовый уровень МБОУ « Дрезненская средняя общеобразовательная школа №1» Коцкая Елена Ивановна, учитель химии 5klass.net
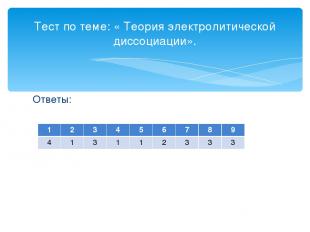
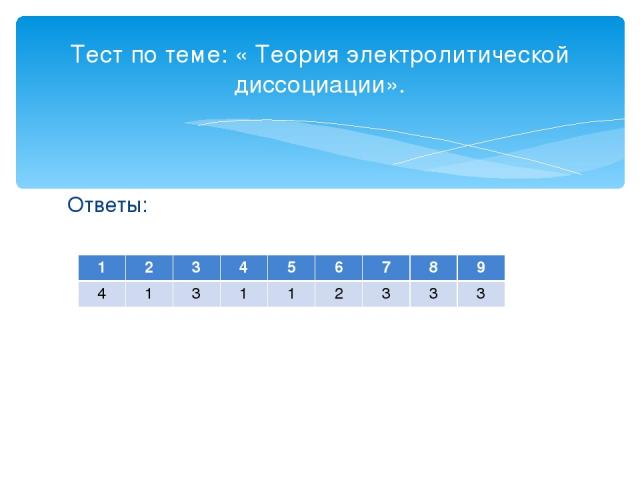
Ответы: Тест по теме: « Теория электролитической диссоциации». 1 2 3 4 5 6 7 8 9 4 1 3 1 1 2 3 3 3

Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате образуется слабый электролит. Любая соль – это продукт взаимодействия основания с кислотой. В зависимости от силы основания и кислоты выделяют 4 типа солей.

Гидролизу не подвергается нерастворимые соли и соли, образованные сильным основанием (щёлочи) и сильной кислотой (HCl, HClO4, HNO3, H2SO4 ), среда раствора нейтральная, рН=7. Гидролизу подвергается: 1) соль, образованная сильным основанием и слабой кислотой (HClO, HNO2, H2S, H2SiO3, H2CO3 включая органические кислоты), гидролиз по аниону, среда щелочная, рН>7. 2) соль, образованная слабым основанием (NH3∙H2O, органические амины, нерастворимые гидроксиды металлов) и сильной кислотой, гидролиз по катиону, среда раствора кислая, рН
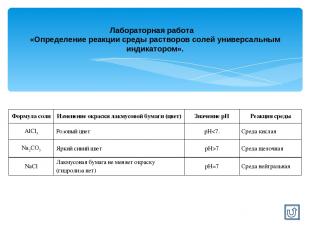
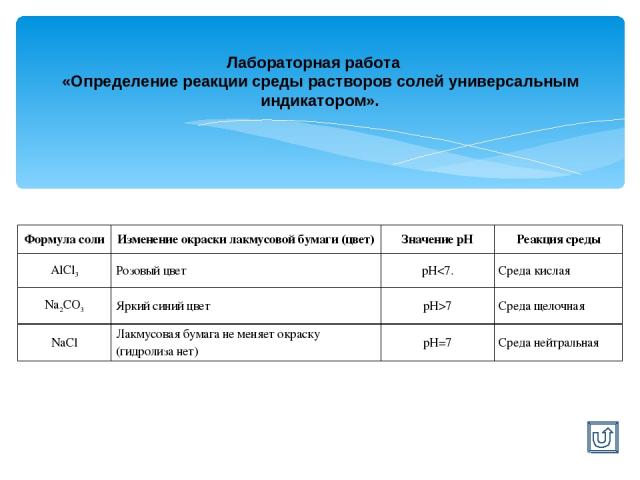
Лабораторная работа «Определение реакции среды растворов солей универсальным индикатором». Формула соли Изменение окраски лакмусовой бумаги (цвет) Значение рН Реакция среды AlCl3 Розовый цвет рН7 Среда щелочная NaCl Лакмусовая бумага не меняет окраску (гидролиза нет) рН=7 Среда нейтральная

Алгоритм составления гидролиза солей Дана соль AlCl3 – образована слабым основанием и сильной кислотой. 1. Составить уравнение диссоциации соли, определить ион слабого электролита. AlCl3↔Al3++3Cl- Al3+ - катион алюминия, слабое основание, гидролиз по катиону 2. Составить уравнение его взаимодействия с водой, определить продукты гидролиза в виде ионов. Al3++H+OH−↔(AlOH)2++H+ 3. Сделать вывод о среде электролита. среда кислая, т.к. [H+]>[OH−] 4. Составить уравнение в молекулярном и ионном виде. AlCl3+HOH↔(AlOH)2+Cl2+HCl Al3++3Cl−+HOH↔(AlOH)2++3Cl−+H+ Al3++HOH↔(AlOH)2++H+

Гидролиз соли Na2CO3, образованной сильным основанием и слабой кислотой. Na2CO3↔2Na++CO2−3 CO2−3 – карбонат - анион, слабая кислота, гидролиз по аниону. CO2−3+HOH↔HCO−3+OH− среда щелочная, т.к. [OH−]> [H+] Na2CO3+HOH↔NaHCO3+NaOH 2Na++CO2−3+H+OH−↔HCO−3+2Na+OH− CO2−3+HOH↔HCO−3+OH−

Гидролиз соли СН3 СООNН4, образованной слабым основанием и слабой кислотой В случае гидролиз соли, образованной слабым основанием и слабой кислотой, образуются конечные продукты – слабое основание и слабая кислота – малодиссоциирующие вещества. Гидролиз необратимый. СН3 СООNН4 + НОН = СН3СООН + NН4ОН Среда определяется сравнением Кд слабых электролитов, а именно большим значением Кд. Кд СН3СООН = 1,75 ∙ 10-5 Кд NН4ОН = 6,3 ∙ 10-5 В данном случае реакция среды будет слабощелочная, т.к Кд NН4ОН несколько больше Кд СН3СООН.
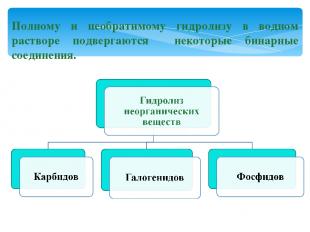
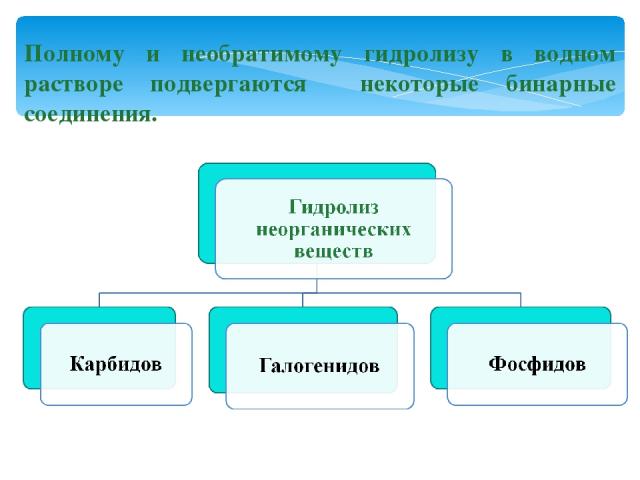
Полному и необратимому гидролизу в водном растворе подвергаются некоторые бинарные соединения.

Гидролиз карбидов: CaC2 + 2H2O = Ca(OH)2 + C2 H2↑ Карбид ацетилен кальция Al4C3 + 12H2O = 4Al(OH)3 + 3CH4↑ Карбид метан алюминия

Гидролиз галогенидов: SiCl4 + 3H2O = H2SiO4↓ + 4HСl хлорид кремниевая кремния (+4) кислота Гидролиз фосфидов: Са3P2 + 6H2O = 3Са(OH)2 + 2PH3↑ фосфид фосфин кальция

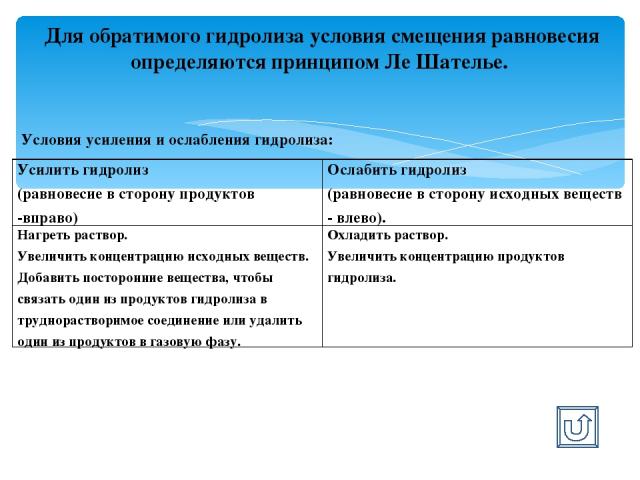
Для обратимого гидролиза условия смещения равновесия определяются принципом Ле Шателье. Условия усиления и ослабления гидролиза: Усилить гидролиз (равновесие в сторону продуктов -вправо) Ослабить гидролиз (равновесие в сторону исходных веществ - влево). Нагреть раствор. Увеличить концентрацию исходных веществ. Добавить посторонние вещества, чтобы связать один из продуктов гидролиза в труднорастворимое соединение или удалить один из продуктов в газовую фазу. Охладить раствор. Увеличить концентрацию продуктов гидролиза.

Разбор примера ( задание частиВ) Как скажется на состоянии химического равновесия в системе Zn2+ + H2O↔ ZnOH+ + H+ – Q 1) добавление H2SO4 2) добавление KOH 3) нагревание раствора 1) добавление H2SO4: H2SO4 =2H+ + SO42– ; повышение концентрации ионов водорода приводит, по принципу Ле Шателье, к смещению равновесия в системе влево. 2) добавление KOH: KOH= K+ + OH– ; H+ + OH– =H2O; гидроксид-ионы связывают ионы водорода в малодиссоциирующее вещество, воду. Снижение концентрации ионов водорода приводит, по принципу Ле Шателье, к смещению равновесия в системе вправо 3) нагревание раствора. По принципу Ле Шателье, повышение температуры приводит к смещению равновесия в сторону протекания эндотермической реакции, т.е. – вправо.
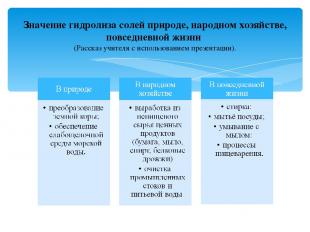
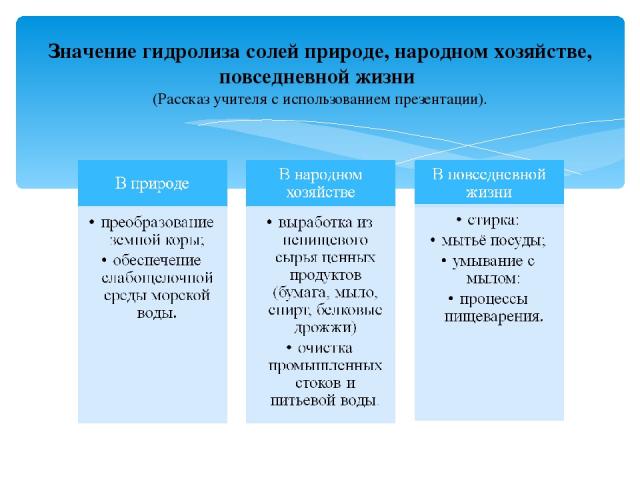
Значение гидролиза солей природе, народном хозяйстве, повседневной жизни (Рассказ учителя с использованием презентации).

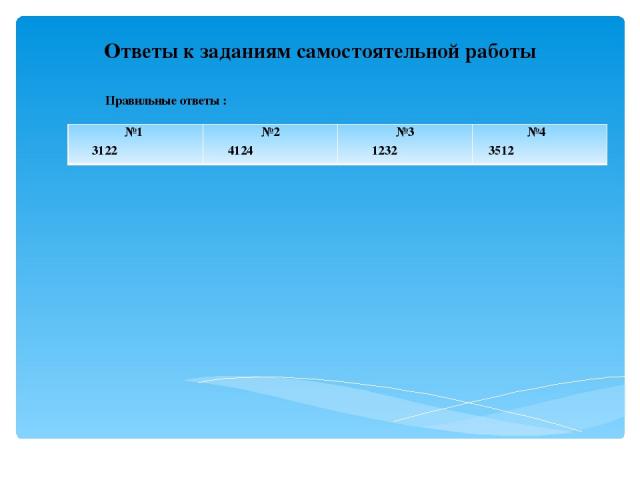
Ответы к заданиям самостоятельной работы Правильные ответы : №1 3122 №2 4124 №3 1232 №4 3512

1.Тема нашего сегодняшнего урока … 2. Передо мной на уроке стояла цель … 3. Сегодня я узнал … 4. Было интересно … 5. Было сложно… 6.Я понял, что … 7. Теперь я могу … 8. Я научился … 9. Я работал на уроке… 10.Выводы урока таковы … Рефлексивная таблица






![Гидролиз соли Na2CO3, образованной сильным основанием и слабой кислотой. Na2CO3↔2Na++CO2−3 CO2−3 – карбонат - анион, слабая кислота, гидролиз по аниону. CO2−3+HOH↔HCO−3+OH− среда щелочная, т.к. [OH−]> [H+] Na2CO3+HOH↔NaHCO3+NaOH 2Na++CO2−3+H+OH−↔HCO… Гидролиз соли Na2CO3, образованной сильным основанием и слабой кислотой. Na2CO3↔2Na++CO2−3 CO2−3 – карбонат - анион, слабая кислота, гидролиз по аниону. CO2−3+HOH↔HCO−3+OH− среда щелочная, т.к. [OH−]> [H+] Na2CO3+HOH↔NaHCO3+NaOH 2Na++CO2−3+H+OH−↔HCO…](https://fs3.ppt4web.ru/images/132073/183467/640/img6.jpg)