Презентация на тему: Галогены

Получение галогенов. Биологическое значение и применение галогенов и их соединений. Урок на тему: 900igr.net

Цель урока: 1. Рассмотреть важнейшие методы синтеза галогенов. 2. Выяснить области применения галогенов и их биологическое значение. 3. Повысить бытовую химическую грамотность.

Возможно ли существование галогенов в природе в виде простых веществ?

В промышленности фтор и хлор получают электролизом расплавов или растворов их солей.

Что такое электролиз? Электролиз – это процесс, происходящий при пропускании через раствор или расплав электролита электрического тока.

Процессы, происходящие при электролизе При электролизе расплава на катоде (-) разряжаются катионы металла, а на аноде (+) разряжаются анионы кислотного остатка.
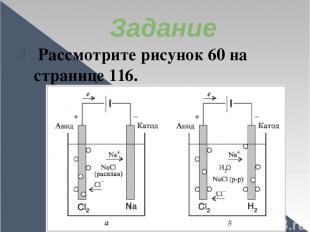
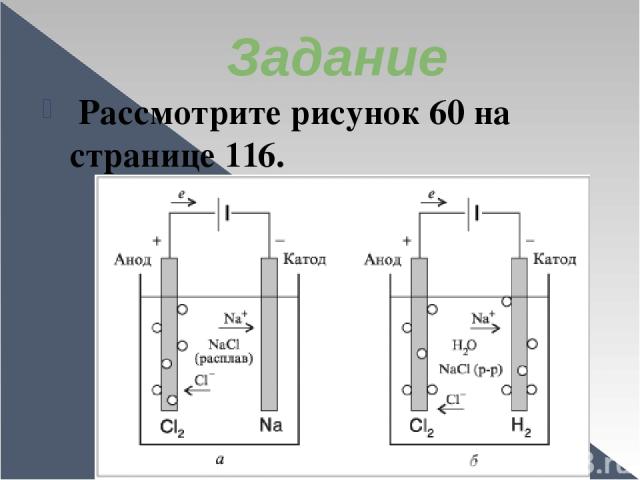
Задание Рассмотрите рисунок 60 на странице 116.

Запишите в тетрадь уравнение реакции электролиза расплава хлорида натрия (страница 116) и электролиза раствора хлорида натрия (страница 117). В чем сходство в данных процессах, в чем отличие?


Получение хлора в лаборатории 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ +8H2O MnO2 + 4HCl → MnCl2 + + Cl2↑ + 2H2O

Астат Этот элемент был предсказан Д.И. Менделеевым под названием экайода и стал вторым (после технеция) синтезированным элементом. Его синтез провели американские ученые Д. Корсон, К. Мак-Кензи и Э. Сегре (1940).

Астат В настоящее время известно 24 искусственных изотопа астата. Все они короткоживущие (отсюда и название элемента: по-гречески означает неустойчивый). Самый стабильный изотоп - его период полураспада около 8 ч. По своим свойствам астат похож и на йод, и на полоний, свинец - имеет выраженные металлические свойства.

Астат Атомы всех изотопов самого тяжелого галогена очень неустойчивы. Их ядра претерпевают быстрый радиоактивный распад, поэтому астата в земной коре чрезвычайно мало (по самым оптимистичным оценкам всего ~30 г), и его свойства остаются малоизученными.

Йод Йод красой своей гордился, Твердым был, но испарился. Фиолетовый, как ночь, Далеко умчался прочь.

Йод Йод был открыт французским химиком Б.Куртуа в 1811 г. Ученый наблюдал появление фиолетовых паров с запахом, похожим на запах хлора, при действии концентрированной серной кислоты на золу морских водорослей. Название йод образовано от греческого - цвет фиалки, фиолетовый.

Йод Содержание йода - 4×10-5 % от массы земной коры. 61-е место по распространенности. Источником йода служат подземные воды, сопутствующие залежам каменного угля и нефти. Йод плохо растворяется в воде, значительно лучше - в спирте и многих других органических растворителях. Спиртовой раствор йода широко применяют для дезинфекции небольших ран на коже.

Йод Йод в нашем организме играет выдающуюся роль. Он обеспечивает нормальное функционирование щитовидной железы, от которой зависит, в частности, и способность человека к умственной работе. Микроколичества йода поступают в организм с пищей, питьевой водой, некоторыми продуктами питания (особенно морского происхождения). В Нижегородской области люди страдают от дефицита йода - его слишком мало в питьевой воде. Для того чтобы компенсировать дефицит йода, используют йодированную соль - поваренную соль, к которой в заводских условиях добавлены микроколичества йодида натрия или калия.

Йод Для того чтобы обезопасить щитовидную железу от накопления в ней атомов радионуклида 131I, которые образуются при работе ядерного реактора и в результате аварии могут попасть в атмосферу, врачи рекомендуют выпить стакан молока, в который добавлена одна капля медицинской йодной настойки. Объем щитовидной железы очень мал, и этого количества йода достаточно, чтобы насытить ее и на неделю лишить способности дополнительно поглощать поступающий в организм йод. После взрыва на Чернобыльской АЭС в нашей стране, к счастью, ни одной аварии, сопровождающейся выбросом в окружающую среду 131I, не было.

Бром Бром разлился океаном, Хоть зловонным, но румяным. Бил себя он грозно в грудь: «Я ведь бром! Не кто-нибудь!..» Бром от греческого - зловоние.

Бром Бром - тяжелая темно-красная жидкость ( ρ = 3,1055 г/см3), образующая желто-бурые пары с резким запахом, способные вызвать поражение дыхательных путей. При попадании жидкого брома на кожу образуются очень болезненные ожоги и трудно заживающие язвы.

Бром Бром хранят в склянках с притертыми стеклянными пробками. Работать с бромом можно только под тягой в маске (очках) и резиновых перчатках. При попадании брома на кожу следует быстро промыть пораженное место спиртом, большим количеством воды, а затем многократно 2%-м раствором пищевой соды. При случайном вдыхании паров брома необходимо вдыхать пары 2%-го раствора аммиака, а затем кислород или свежий воздух.

Бром Содержание брома в земной коре невелико. На долю брома приходится 1,6×10-4 % от массы земной коры. Своих минералов практически не образует. В небольших количествах содержится в морской воде. Источником брома в промышленности служат воды некоторых озер.

Бром Физиологическая роль брома в организме незначительна. Все слышали, что врачи назначают «бром» как успокоительное средство. Понятно, что речь идет не о простом веществе бром (бром очень ядовит). Больным прописывают раствор бромида натрия или калия. Бромом богаты чечевица, фасоль, стручки гороха. У животных бром обнаружен в крови, спинномозговой жидкости, гипофизе, надпочечниках.

Бром Бромид серебра применяют в фотографии. Бромид натрия добавляют в дубильные растворы для получения более твердой кожи. Из прозрачных кристаллов KBr делают линзы, которые великолепно пропускают инфракрасные лучи и применяются в приборах ночного видения.

Бром Бромид лития предотвращает коррозию в холодильных установках, обезвоживает минеральные масла, помогает кондиционировать воздух. В текстильной отрасли промышленности широко используют броминдиго, с помощью которого получают целую гамму ярких и чистых цветов от синего до красного.

Хлор На долю хлора приходится 0,017% от массы земной коры. Хлор входит в состав минерала галита (NаCl), сильвина (KCl), сильвинита (NaCl×KCl) и других. Хлор хвалился: «Нет мне равных! Галоген я самый главный. Зря болтать я не люблю: Все на свете отбелю!» Хлор от греческого - желто-зеленый.

Хлор Температура кипения хлора -33,97 °C; хлор - зеленовато-желтый газ с резким запахом, в 2,5 раза тяжелее воздуха; при повышенном давлении переходит в жидкое состояние (желтая жидкость) уже при комнатной температуре, поэтому его удобно транспортировать и хранить в жидком виде в баллонах. Баллоны с хлором выкрашены в зеленый цвет. Растворимость хлора в воде мала. Раствор, полученный при поглощении 2,5 объемов Cl2 одним объемом воды, называется хлорной водой.

Хлор При незначительном содержании газа в воздухе, когда ощущается лишь слабый запах, хлор оказывает обеззараживающее воздействие. Однако длительное вдыхание воздуха с содержанием хлора выше 0,01 мг/л вызывает сильное раздражение слизистых оболочек дыхательных путей, жжение во рту и кашель, а порой приводит к смерти от удушья.

Хлор Хлор относится к группе удушающих веществ. Он был первым боевым отравляющим веществом, примененным немцами во время Первой мировой войны. Действие отравляющих веществ на организм различно. Одни, как хлор, поражают главным образом органы дыхания, другие, как хлорпикрин Cl3CNO2, преимущественно поражают глаза и вызывают сильное слезотечение (слезоточивые отравляющие вещества), некоторые, как иприт (С2Н4Cl)2S и люизит СНCl=СНAsCl2, вызывают нарывы на коже (нарывные отравляющие вещества).

Хлор Впервые хлор был использован в медицине. Раствор CaCl(OCl) в воде - хлорная известь - рекомендовался как дезинфицирующее средство врачам и студентам-медикам при работе в моргах.

Хлор С помощью соединений, содержащих хлор, легко и быстро отбеливают хлопчатобумажные, льняные ткани и целлюлозу (соответственно в текстильной и бумажной отраслях промышленности). Ведь до появления этих соединений в некоторых европейских, особенно северных, странах весенней порой поля и луга устилали льняными тканями, которые под воздействием солнечных лучей и других природных факторов приобретали необходимую белизну. Для лугового отбеливания ткани из Англии отправляли даже в Голландию, а купцы из французского города Бордо вывозили ткани на африканские побережья.

Хлор Суточная потребность взрослого человека в хлоре (2-4 г) обеспечивается за счет пищевых продуктов. Особенно богаты хлором хлеб, мясные и молочные продукты. В организме хлор играет большую роль, хлорид-ионы способствуют удержанию тканями воды при водно-солевом обмене.

Хлор На высоте 15-25 км над землей находится озоновый слой атмосферы, защищающий живые объекты от жесткого ультрафиолетового излучения. При попадании в атмосферу хлорсодержащие соединения диссоциируют под действием УФ-света с образованием атомов хлора, которые реагируют с озоном: . Cl + O3 = .ClO + O2 В 1987 г. 36 государств подписали Монреальский протокол о снижении производства фреонов как самых опасных разрушителей озона. Запуски космических челноков также сильно разрушают озоновый слой. При одном старте «Шаттла» в атмосферу попадает около 200 т хлора. Один атом хлора в состоянии уничтожить около 100 тыс. молекул озона: . Cl + O3 --> . ClO + O2, O3 --> O2 + О ., .ClO + O .--> . Cl + O2

Фтор В земной коре наиболее распространен фтор - 0,065% по массе, 13-е место, в основном встречается в составе двух минералов - плавикового шпата СаF2 и фторапатита 3Са3(PO2)2×CaF2

Фтор В периодической системе под № 9 находится элемент, образующий простое вещество с экстремальными свойствами. В мире он известен под двумя именами. За рубежом его называют флюором, что в переводе с латинского означает «текучий». Это название берет начало от слова «флюорит», т.е. плавиковый шпат. (Этот минерал способен снижать температуру плавления руды.) Флюорит - первое из соединений фтора, которое использовал человек. В России его называют фтором. Значение фтора в современном мире трудно переоценить, но за ним тянется слава агрессивного, опасного, ядовитого разрушителя. Фтор - от греческого phthoros - разрушение.

Фтор Фтор не зря называют неукротимым. Он образует соединения со всеми химическими элементами. В токе фтора воспламеняются древесина, резина и даже… вода. Такая активность обусловлена особенностями строения атома и молекулы фтора. Фтор единственный непосредственно реагирует и образует соединения с благородными металлами (золото, платина и др.), а также с инертными газами (кроме гелия, неона и аргона).

Фтор Пластмассу тефлон называют органической платиной, перед ней бессильны «царская водка» и расплавленные щелочи, высокие и низкие температуры. В таких соединениях нуждается ракетная, атомная, авиационная техника. Фтор - самый сильный окислитель, это свойство позволяет использовать его в качестве окислителя ракетного топлива. Фтор - верный слуга человека во многих отраслях промышленности. Его соединения применяют в оптической и лазерной технике, при изготовлении полупроводниковых приборов и космической аппаратуры, в современных вычислительных устройствах и ядерной энергетике.

Фтор Фтор в составе фторапатита входит в состав зубной эмали, которая обеспечивает твердость наших зубов. При недостатке фтора защитный слой фторапатита разрушается, и появляется кариес. При избытке фтора наблюдается повышенная хрупкость костей.

Фтор Фтор входит в состав полимеров, лекарств, моющих средств, ядохимикатов, красителей, компонентов искусственной крови. Еще во время Второй мировой войны были созданы боевые отравляющие вещества нервно-паралитического действия - зарин, зоман, содержащие в своем составе фтор. Фториды используются в медицине, растениеводстве и животноводстве. С ними связывают перспективу лечения рака и регулирования наследственности, создание мощных психотропных средств, транквилизаторов, антибиотиков.

Домашнее задание §20, записи в тетради Подготовиться к проверочной работе по теме «Галогены. Значение галогенов».