Презентация на тему: Галогены и их соединения

Соединения галогенов. 900igr.net

Цели урока: Рассмотреть свойства и применение важнейших соединений галогенов. Изучить качественные реакции на галогенид-ионы. Рассмотреть свойства и применение важнейших соединений галогенов и способы получения галогенов.

Основное содержание Понятие о галогеноводородах Галогеноводородные кислоты Оксокислоты Галогениды.(соли) Значение соединений галогенов.

Соединения галогенов Галогеноводороды, – Это едкие газы с резким запахом, хорошо раствормые в воде HF HCl HBr HI фтороводород хлороводород бромоводород йодоводород

Получение хлороводорода NaСl(тв) + Н2SО4(конц) = НСl↑ + КНSО4.

Галогеноводородные кислоты Образуются при растворении галогеноводородов в воде. HF HCl HBr HI Фтороводородная кислота ( плавиковая) хлороводородная кислота (соляная) бромоводородная кислота йодоводородная кислота

Оксокислоты Хлорная – НСlO4 Сl2O7 Хлорноватая – НСlO3 Сl2O5 Хлористая – НСlO2 Сl2O3 Хлорноватистая- НСlO Сl2O

Соли Фториды Хлориды Бромиды Йодиды Галогениды Na F KCl KBr NaI

Качественная реакция на галогенид - ионы Взаимодействие с ионом серебра: (AgNO3) AgNO3 + KCl = KNO3 + AgCl (белый ) AgNO3 + KВr = KNO3 + AgBr(Светло-желтый) AgNO3 + KI = KNO3 + AgI( желтый)

Фтор F2 Открыт Муассаном в 1886 году электролизом безводного фторида углерода Плавиковый шпат СаF2 Криолит: Na3AlF6

Соединения фтора n(-CF2-CF2-) Тефлон устойчив к действию всех известных кислот и их смесей. Он выдерживает температуры от -269 до +200°С. Плавиковая кислота: HF Разъедает стекло Зарин и зоман- Боевые отравляющие вещества

Галит (NaCl ) Хлор ДДТ (дихлородифенилтрихлорэтан) KClO3 - Бертолетова соль. 2KClO3 + 3S = 2KСl + 3SO2↑.

AgBr- фотография NaBr- дубление кожи KBr- линзы LiBr- используется в кондиционерах. Бром

Получил Б.Куртуа. (1811 г) 2NaI + 2H2SO4 = I2 + SO2↑ + Na2SO4 + 2H2O 3I2 + 5NH3 = I3N∙NH3↓ + 3NH4↑. моноаммиакат нитрида трииода I3N∙NH3. Йод
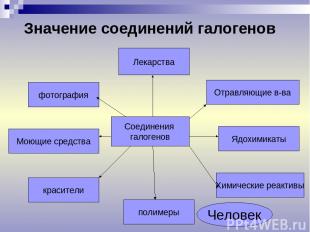
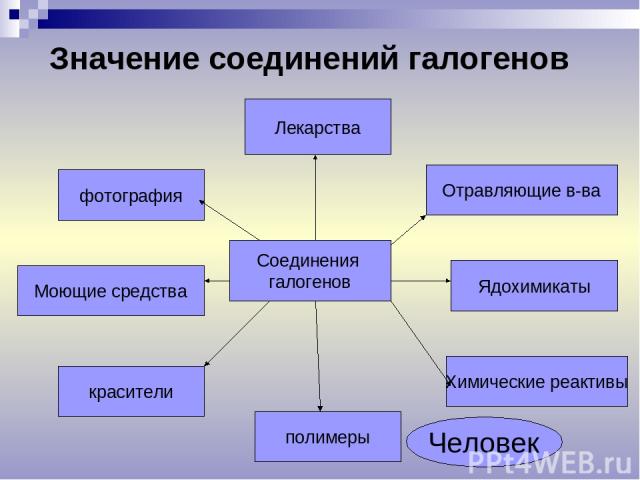
Лекарства Моющие средства красители полимеры Химические реактивы Ядохимикаты Отравляющие в-ва фотография Значение соединений галогенов Соединения галогенов Человек