Презентация на тему: Химия «Серная кислота»

900igr.net

«Я растворю любой металл. Меня алхимик получал В реторте глиняной простой. Слыву я главной кислотой... Когда сама я растворяюсь в воде, то сильно нагреваюсь…»

Основные вопросы Нахождение в природе Физические свойства Применение Получение Свойства

Физические свойства Бесцветная, тяжёлая, нелетучая жидкость Гигроскопичная (водоотнимающая) t кип. = 340ºС Сначала вода, потом кислота – иначе случится большая беда! Н2О
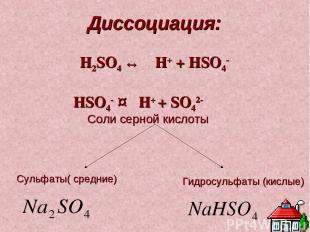
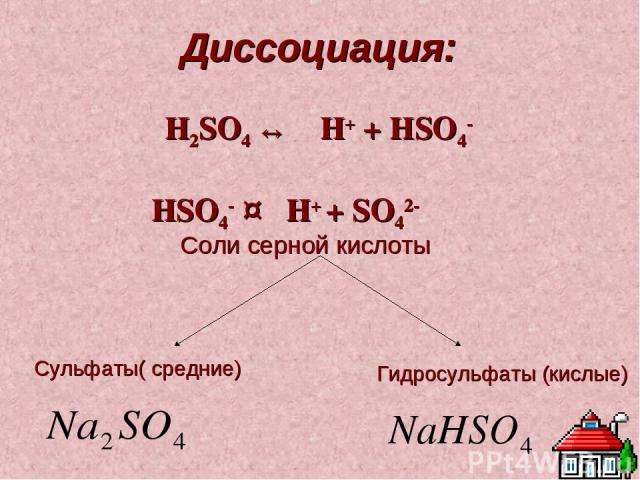
Диссоциация: H2SO4 ↔ H+ + HSO4- HSO4- ↔ H+ + SO42- Соли серной кислоты Сульфаты( средние) Гидросульфаты (кислые)
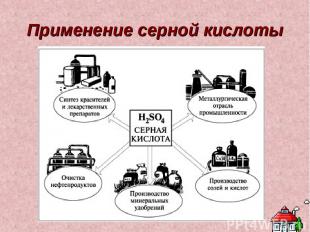
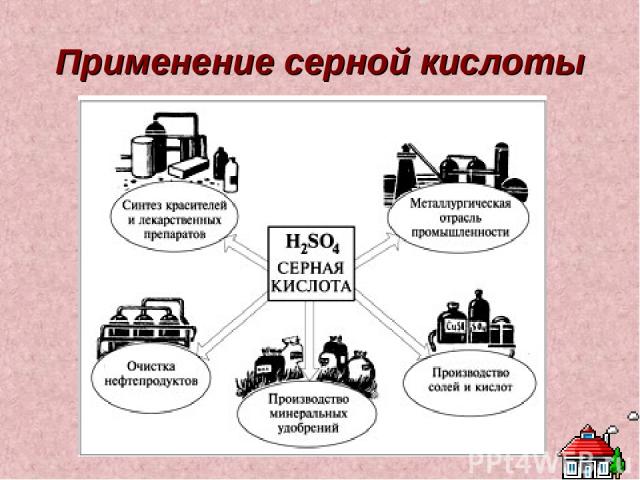
Применение серной кислоты
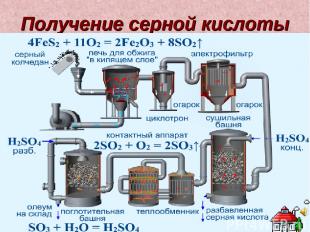
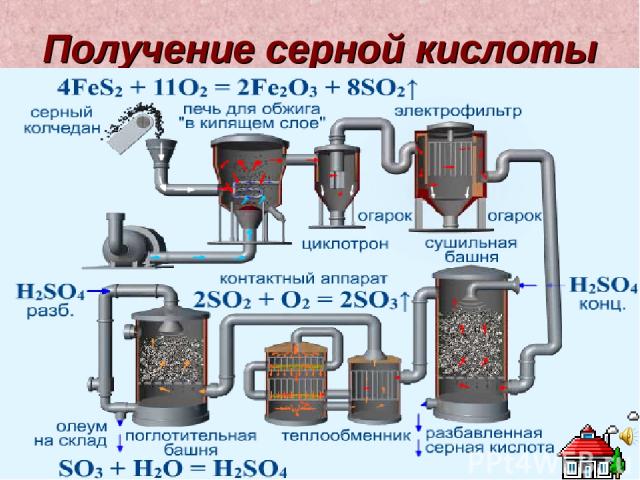
Получение серной кислоты

Серная кислота в природе В одном из 3 кратеров вулкана Малый Семячик (Камчатка) образовалось озеро шириной 500 метров и глубиной 140 метров состоит из прогретого до 40 градусов раствора серной и соляной кислоты средней концентрации.

Лабораторная работа: Свойства разбавленной серной кислоты Задание 1: Возьмите две пробирки. В одну пробирку поместите Zn, в другую пробирку поместите Cu, в обе пробирки прилейте раствор серной кислоты. Что наблюдаете? Запишите уравнения химических реакций в окислительно- восстановительном виде. !!! Помним и соблюдаем правила техники безопасности.

Задание 2: Возьмите две пробирки. В одну пробирку поместите CuO, в другую пробирку поместите MgO, в обе пробирки прилейте раствор серной кислоты. Что наблюдаете? Запишите уравнения химических реакций в молекулярном и ионном виде. !!! Помним и соблюдаем правила техники безопасности.

Задание 3: В пробирку налейте раствор NaOH, затем добавьте фенолфталеин. Что наблюдаете? Добавьте раствор серной кислоты. Что наблюдаете? Запишите уравнение химических реакций в молекулярном и ионном виде. !!! Помним и соблюдаем правила техники безопасности.

Задание 4: Возьмите две пробирки. В одну пробирку налейте раствор Na2CO3, в другую пробирку раствор BaCl2, в обе пробирки прилейте раствор серной кислоты. Что наблюдаете? Запишите уравнения химических реакций в молекулярном и ионном виде. !!! Помним и соблюдаем правила техники безопасности.

Химические свойства разбавленной серной кислоты Кислота + металл( до H2) = соль + водород Кислота + оксид металла = соль + вода Кислота + основание = соль + вода Кислота + соль = соль + кислота (если образуется осадок или газ)


Свойства концентрированной серной кислоты Cu + 2H2SO4(конц) → SO2 + CuSO4 + 2H2О Cu0 + 2е → Cu+2 1 восстановитель, окисляется S+6 + 2е→ S+4 1 окислитель, восстанавливается 4Zn + 5H2SO4(конц)→ H2S + 4ZnSO4 + 4H2О Zn0 + 2е → Zn+2 4 восстановитель, окисляется S+6 + 8е→ S-2 1 окислитель, восстанавливается

Домашнее задание §23 упр.3,4 стр. 142