Презентация на тему: Химическое равновесие

Химическое равновесие. Принцип Ле-Шателье Урок в 9 классе 900igr.net
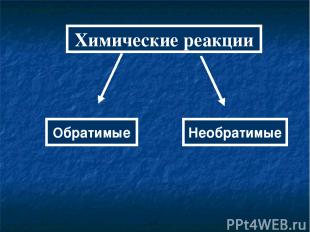
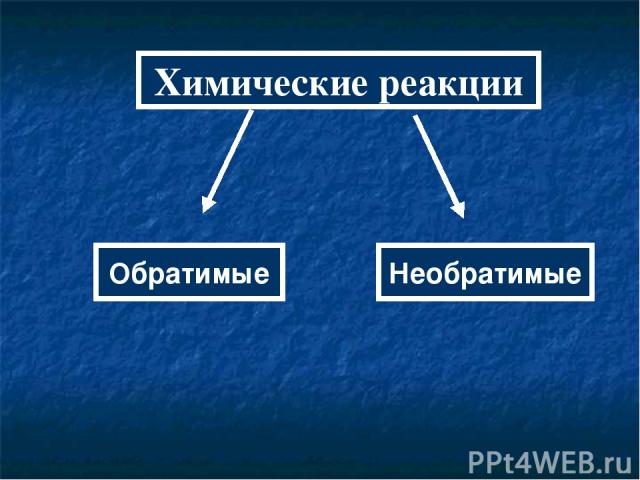
Химические реакции Обратимые Необратимые

Задание 1: Написать факторы, влияющие на скорость химических реакций

Задание 2 : Написать кинетические уравнения для химических реакций II вариант H2S + SO2 S + H2O I вариант HCl + O2 H2O + Cl2

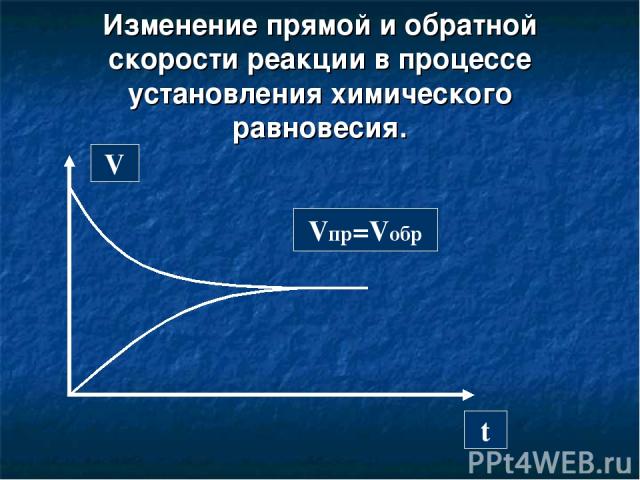
Состояние системы, при котором скорость образования новых продуктов равна скорости их превращения в исходные вещества, называется химическим равновесием. Vпр=Vобр
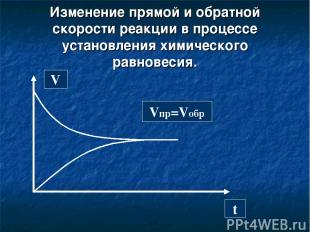
Изменение прямой и обратной скорости реакции в процессе установления химического равновесия. V t Vпр=Vобр

Равновесными концентрациями называются концентрации всех веществ системы, которые устанавливаются в ней при наступлении состояния химического равновесия

Константа равновесия – это отношение произведений концентраций продуктов реакций к произведению концентраций исходных веществ
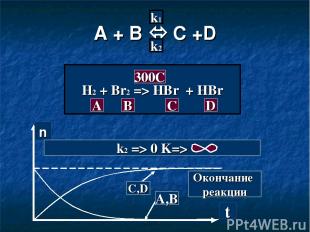
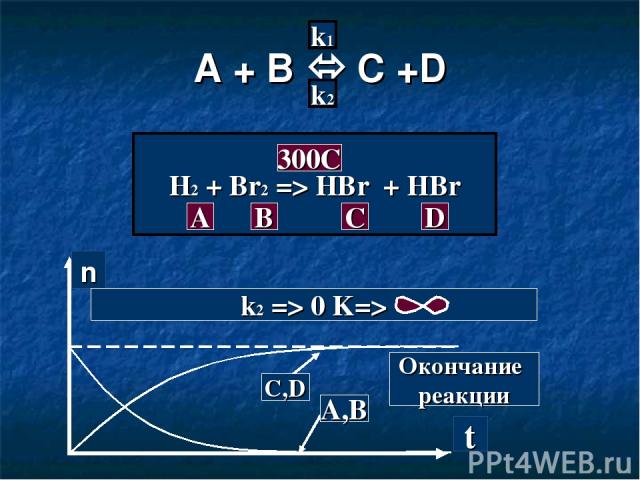
A + B C +D k1 k2 H2 + Br2 => HBr + HBr A B C D 300C n t C,D A,B Окончание реакции k2 => 0 K=>
![K = k1:k2 = =[C]равн*[D]равн:[A]равн*[B]равн 300C H2 + I2 HI + HI A B C D t C,D K = k1:k2 = =[C]равн*[D]равн:[A]равн*[B]равн 300C H2 + I2 HI + HI A B C D t C,D](https://fs3.ppt4web.ru/images/132073/184118/310/img9.jpg)
K = k1:k2 = =[C]равн*[D]равн:[A]равн*[B]равн 300C H2 + I2 HI + HI A B C D t C,D A,B Установление равновесия k1>k2; K = k1\k2 > 1 n

Условия смещения химического равновесия - принцип Ле - Шателье «Бегство от насилия»

Если на систему, находящуюся в равновесии, производится какое-либо внешнее воздействие, то оно благоприятствует протеканию такой реакции, которая ослабляет данное воздействие

A + B C + Q t+ t-

C A + B - Q t- t+
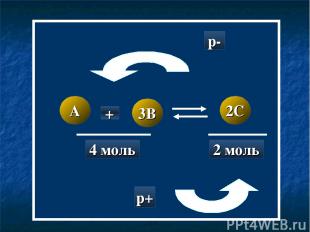
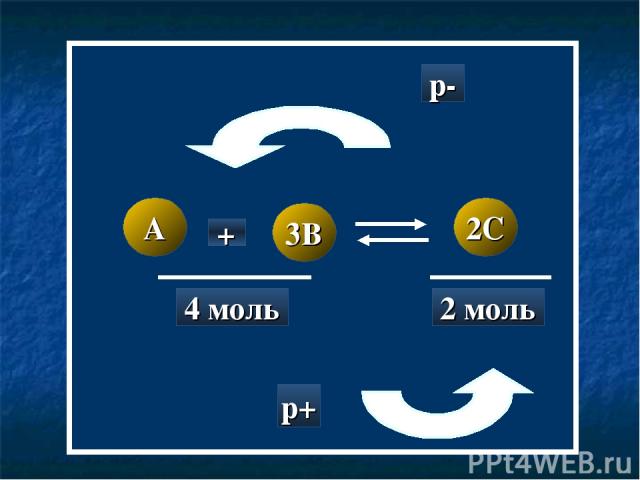
A 3B 2C + 4 моль 2 моль p- p+
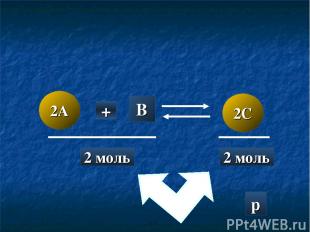
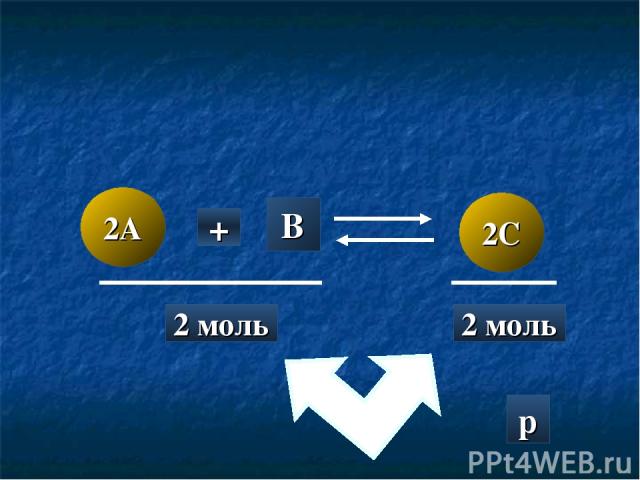
2A 2C + B 2 моль 2 моль p
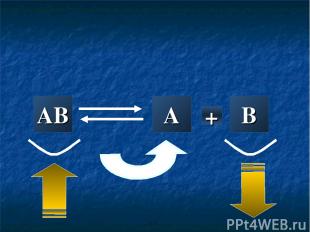
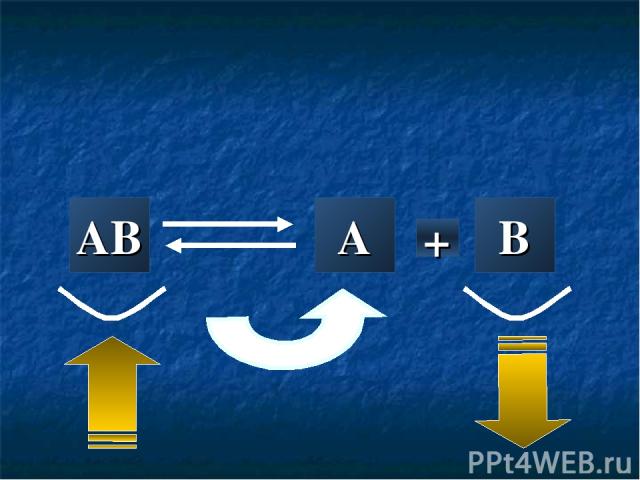
AB A + B
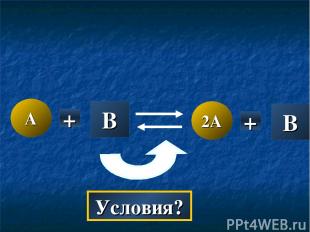
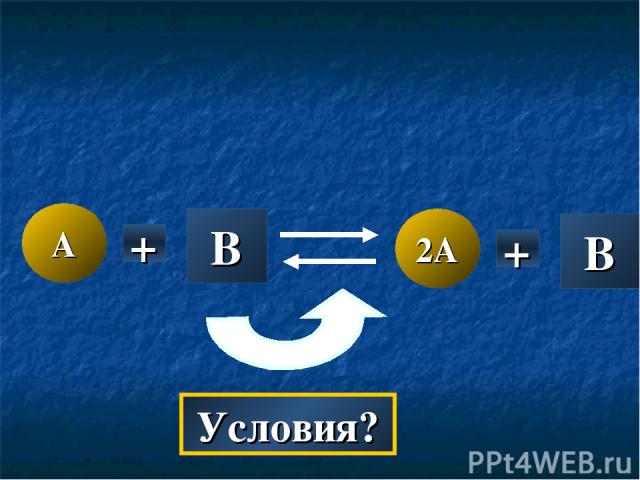
A 2A + B B + Условия?

Домашнее задание Рассмотреть и описать графики 3 и 4 10.5, стр. 63(сборник задач) Выучить определения Тест







![K = k1:k2 = =[C]равн*[D]равн:[A]равн*[B]равн 300C H2 + I2 HI + HI A B C D t C,D A,B Установление равновесия k1>k2; K = k1\k2 > 1 n K = k1:k2 = =[C]равн*[D]равн:[A]равн*[B]равн 300C H2 + I2 HI + HI A B C D t C,D A,B Установление равновесия k1>k2; K = k1\k2 > 1 n](https://fs3.ppt4web.ru/images/132073/184118/640/img9.jpg)