Презентация на тему: Химическое равновесие

Урок на тему: « Химическое равновесие »

Цели урока:1. Сформировать понятие обратимых процессов2. Подвести к выводу о равенстве скоростей прямой и обратной реакций в момент достижения химического равновесия.3. Показать учащимся приемы осмысленного чтения информационного текста.4. Продолжить развитие умения работать в группе.I. Проверка домашнего задания. I I. Обсуждение нового материала.

Технологическая карта урока:- Вызов- Мозговой штурм- Составление кластера- Осмысление - Рефлексия- Возвращение к кластеру

Структура урока: Стадия "Вызов"Стадия "Осмысление"Стадия "Размышление"

Стадия «Вызов»
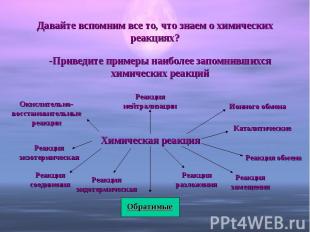
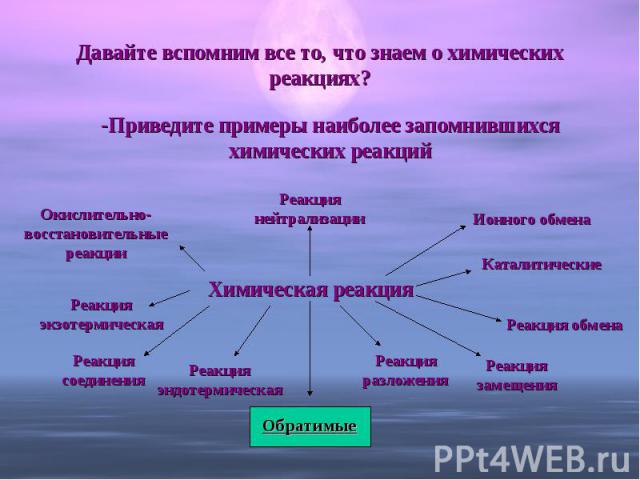
Давайте вспомним все то, что знаем о химических реакциях? -Приведите примеры наиболее запомнившихся химических реакцийХимическая реакция
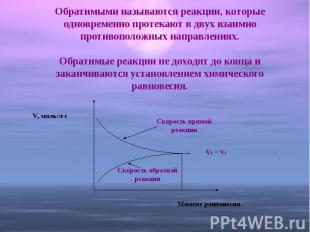
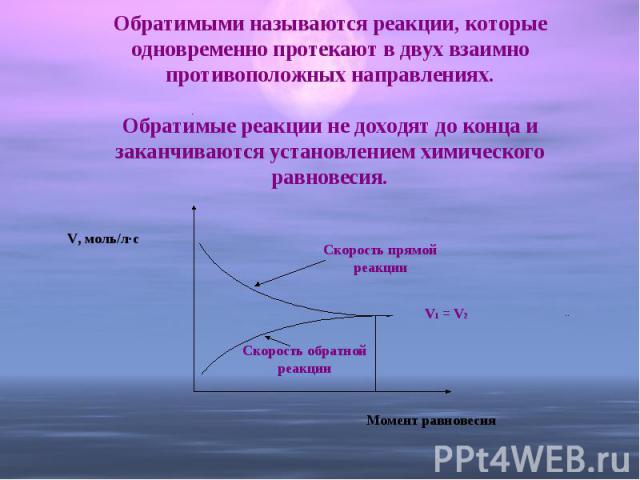
Обратимыми называются реакции, которые одновременно протекают в двух взаимно противоположных направлениях.Обратимые реакции не доходят до конца и заканчиваются установлением химического равновесия.

Если вы правильно решите химический ребус, то получится название основного правила, которому подчиняются сдвиги химического равновесия. Известен Всюду на ЗемлеАнри Луи Ле ШательеОн не был королем и принцем,Зато открыл прекрасный принцип,Который химикам полезен.

Стадия «Осмысление»

Работа с информационным текcтом:I группа - § 19.2 стр. 81II группа - § 19.2 стр. 82 III группа - § 19.2 стр. 83

Прочитайте текст.Цель: а) обогатить свои знания новой информацией.б) проверить, в чем мы правы, а в чем – нет, снять все противоречия.

Читая текст, учащиеся делают пометки карандашом (метод «Инсерт»)«?» - толстые и тонкие вопросы по ходу чтения( работа в группах)

Допустим, что химическая реакция представляет собой весы. На левой чаше весов находится исходные вещества, на правой – продукты реакции.

Рассмотрим влияние различных факторов на смещение химического равновесия: 1.КонцентрацииПовышение концентрации исходных веществКонцентрация исходных веществ увеличилась, следовательно, чаша весов стала тяжелее, а химическое равновесие сместилось вправо. Повышение концентрации продуктов реакцииКонцентрация продуктов реакции увеличилась, следовательно, чаша весов стала тяжелее, а химическое равновесие сместилось влево.

2. Температура 2 SO2 + O2 = 2 SO3 + Q (экзотермическая реакция) Понижение t в экзотермической реакцииМы «отводим» теплоту с правой чаши, значит, оно становится легче, и химическое равновесие смещается вправо.Повышение t в экзотермической реакцииМы «добавляем» теплоту на правую чашу, значит, оно становится тяжелее, и химическое равновесие смещается влево.

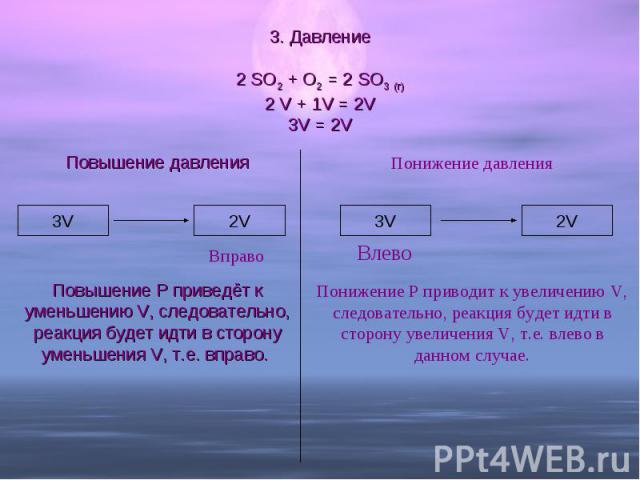
3. Давление 2 SO2 + O2 = 2 SO3 (г)2 V + 1V = 2V3V = 2V Повышение давленияПовышение Р приведёт к уменьшению V, следовательно, реакция будет идти в сторону уменьшения V, т.е. вправо. Понижение давленияПонижение Р приводит к увеличению V, следовательно, реакция будет идти в сторону увеличения V, т.е. влево в данном случае.

Беседа с классом по вопросам:1. Что из того, что вы прочитали, вам уже было знакомо?2. Что из того, что вы прочитали, оказалось новой информацией?3. Давайте озвучим «тонкие и толстые» вопросы и постараемся на них ответить.

Стадия «Размышление»

Химик толкает реакцию в спину:«Давай-ка тебя я немного подвину!»Она отвечает: «Ты знаешь меня:Ни часа, ни дня не могу без огня!И чтобы улучшить моё настроение,Прошу, даже требую: выше давление!К тому же учти: Я – такая реакция,Что мне реагентов важна концентрация».И химик подумал: «Теперь мне всё ясно,Тепло поглощаешь – и это прекрасно.Как только над колбой зажгутся горелки,Ступай-ка реакция, прямо по стрелке.Вот это цветочки, но будут и фрукты – Повысит давление выход продукта!Визг концентрации…Да, ты права:Побольше я выдал тебе вещества».Реакция стала работать послушно,Продукт образуя полезный и нужный.Такой вот привиделся химику сонКакие же выводы сделает он?

Самостоятельная работа I вариантКак сместится равновесие реакции:2 NOг + O2 = 2 NO2 Г - Qа) при понижении давления?б) при повышении температурыОтвет обоснуйте.II вариантКак повлияет на смещение равновесия:N2г + O2 = 2 NOг – Qа) увеличение температуры?б) уменьшение давления?Ответ обоснуйте.
Оценки за урок

Работа в группах:Дополнить банк идей (возвращение к кластеру)Самостоятельная работаДомашнее задание: § 19.3, упражнение