Презентация на тему: Щелочноземельные металлы

Щелочноземельные металлы Вторая группа главная подгруппа наряду с семейством щелочноземельных металлов включает и два типических элемента –бериллий и магний
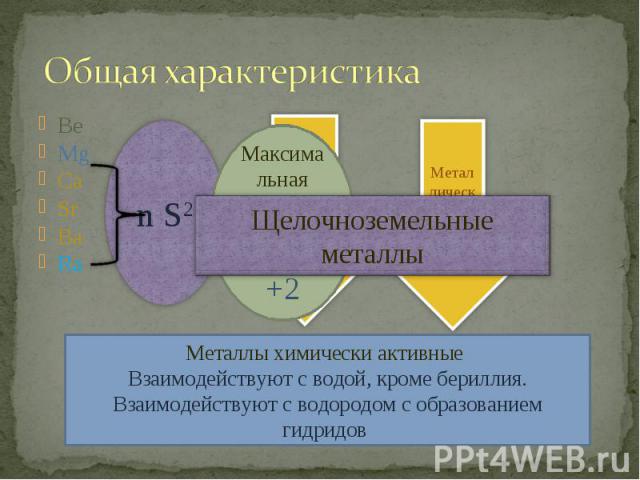
Общая характеристика Щелочноземельные металлыМеталлы химически активные Взаимодействуют с водой, кроме бериллия.Взаимодействуют с водородом с образованием гидридов

Бериллий Бериллий сходствует с алюминием и магнием…Получил своё название потому, что находится в минерале берилле. Металл называют также глицием от греческого слова «сладкий», потому что соли его имеют сладковатый вкус. Д.И.Менделеев

Распространение в природе Александрит редкий камень. Его производят и искусственным путём, однако идёт он не на продажу, а на использование в аэрокосмической отрасли

Получение В виде простого вещества бериллий получили в 1828году немецкий учёный Фридрих Вёлер и французский химик Антуан Бюсси. Они действовали калием на безводный хлорид бериллия BeCl2+2K=Be+2KCl

BeF2+Mg=Be+MgF2 В настоящее время бериллий получают, восстанавливая его фторид магнием, либо электролизом расплава смеси хлоридов бериллия и натрия.

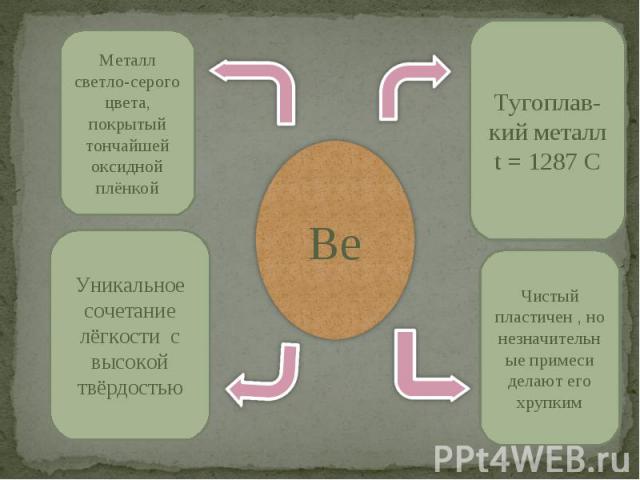
Be Металл светло-серого цвета, покрытый тончайшей оксидной плёнкойУникальное сочетание лёгкости с высокой твёрдостьюТугоплав-кий металлt = 1287 C Чистый пластичен , но незначительные примеси делают его хрупким

Химические свойства

Магний Магний был открыт при анализе воды из минерального источника вблизи города Эпсом в Англии. Горькая на вкус она привлекла внимание исследователей, при упаривании такой воды на стенках сосуда образовывалась белая корка вещества, соль MgSO4 7H2O

Поучение Впервые магний был получен в 1808г Гемфри Деви при электролизе влажной магнезии . По его предложению элемент назвали Magnium

Физические свойства

Распространение в природе Магний входит в состав активного центра зелёного пигмента растений -хлорофилла

Химические свойства Горение на воздухе 2Mg+ O2=2MgOПри комнатной температуре не взаимодействует с водой, лишь при кипячении Mg+2H2O=Mg(OH)2 +H2Магний легко взаимодействует с разбавленными кислотамиХимически активенСильный восстанови-тель

Применение
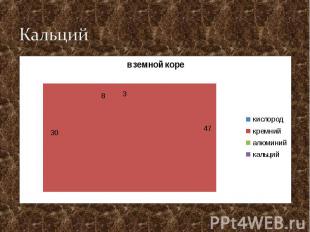
Кальций

Распространение в природе

Получение Электролиз расплавов солей CaCl2 =Ca+Cl2Алюмотермия CaO +Al=CaAlO+Ca
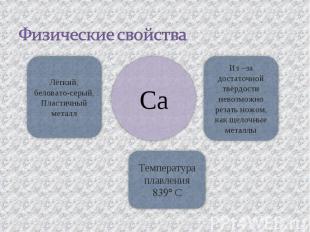
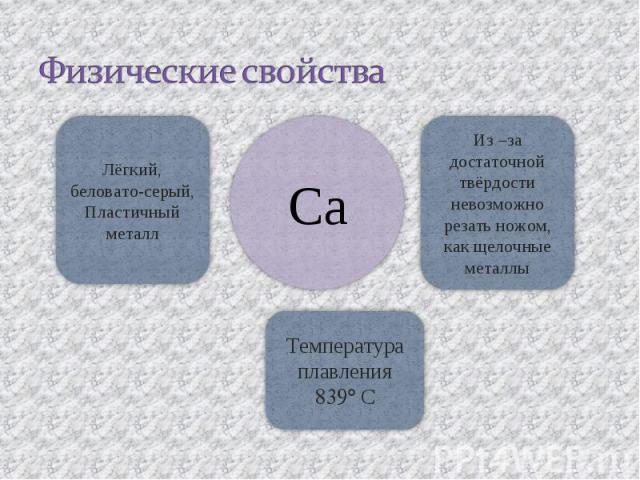
Физические свойства

Химические свойства С простыми веществами Ca+H2=CaH2 Ca+Cl2=CaCl2Ca+N2=Ca3N

Химические свойства Со сложными веществамиCa+NH3=Ca(NH2)2 +H2Ca+H2O=Ca(OH)2+H2Ca+HCl=CaCl2+H2 любая кислота кроме азотной
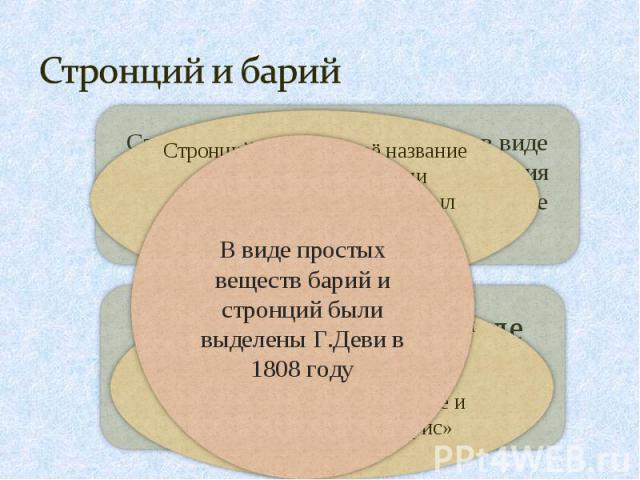
Стронций и барий В виде простых веществ барий и стронций были выделены Г.Деви в 1808 годуСтронций получил своё название от шотландской деревни Стронциан, близь которой был найден редкий минерал стронцианитВпервые барий был обнаружен шведским химиком Карлом Вильгельмом Шееле и его учеником в тяжёлом шпате и получил название «барис» тяжёлый.

Применение Соединения кальция, стронция и бария применяют в разных отраслях промышленности и строительстве.Соединения стронция(нитрат, карбонат ,хлорид, оксалат) используют в производстве осветительных ракет, химического и термически устойчивого стекла. Оксид стронция входит в состав эмалей для защиты металлических предметов.Используют в производстве белой краски литопон, обладающей высокой кроющей способностьюДобавка в производстве бумаги дорогих сортов- денежных знаков и документовИзготовление защитных материалов для рентгеновских установок, в медицине

Спасибо за внимание Презентацию выполнила учитель химии Тихомирова И.Ю. МОУ лицей № 20 г.Кострома