Презентация на тему: Щелочноземельные металлы

Be Be Mg Ca Sr Ba Ra

Бериллий сходствует с алюминием и магнием…Получил своё название потому, что находится в минерале берилле. Металл называют также глицием от греческого слова «сладкий», потому что соли его имеют сладковатый вкус. Д.И.Менделеев Бериллий сходствует с алюминием и магнием…Получил своё название потому, что находится в минерале берилле. Металл называют также глицием от греческого слова «сладкий», потому что соли его имеют сладковатый вкус. Д.И.Менделеев


В виде простого вещества бериллий получили в 1828году немецкий учёный Фридрих Вёлер и французский химик Антуан Бюсси. Они действовали калием на безводный хлорид бериллия В виде простого вещества бериллий получили в 1828году немецкий учёный Фридрих Вёлер и французский химик Антуан Бюсси. Они действовали калием на безводный хлорид бериллия BeCl2+2K=Be+2KCl

BeF2+Mg=Be+MgF2 В настоящее время бериллий получают, восстанавливая его фторид магнием, либо электролизом расплава смеси хлоридов бериллия и натрия. BeF2+Mg=Be+MgF2 В настоящее время бериллий получают, восстанавливая его фторид магнием, либо электролизом расплава смеси хлоридов бериллия и натрия.


Обладая высокой химической активностью бериллий вступает в реакции с галогенами, серой и азотом. Вода на него не действует, зато подобно алюминию он легко растворяется как в разбавленных кислотах , так в растворах щелочей. Обладая высокой химической активностью бериллий вступает в реакции с галогенами, серой и азотом. Вода на него не действует, зато подобно алюминию он легко растворяется как в разбавленных кислотах , так в растворах щелочей.

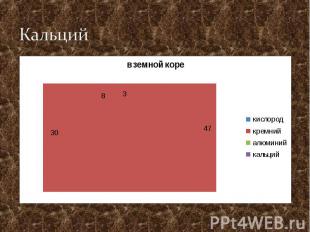
Магний был открыт при анализе воды из минерального источника вблизи города Эпсом в Англии. Горькая на вкус она привлекла внимание исследователей, при упаривании такой воды на стенках сосуда образовывалась белая корка вещества, соль MgSO4 7H2O Магний был открыт при анализе воды из минерального источника вблизи города Эпсом в Англии. Горькая на вкус она привлекла внимание исследователей, при упаривании такой воды на стенках сосуда образовывалась белая корка вещества, соль MgSO4 7H2O

Впервые магний был получен в 1808г Гемфри Деви при электролизе влажной магнезии . По его предложению элемент назвали Magnium Впервые магний был получен в 1808г Гемфри Деви при электролизе влажной магнезии . По его предложению элемент назвали Magnium



Горение на воздухе 2Mg+ O2=2MgO Горение на воздухе 2Mg+ O2=2MgO При комнатной температуре не взаимодействует с водой, лишь при кипячении Mg+2H2O=Mg(OH)2 +H2 Магний легко взаимодействует с разбавленными кислотами




С простыми веществами С простыми веществами Ca+H2=CaH2 Ca+Cl2=CaCl2 Ca+N2=Ca3N

Со сложными веществами Со сложными веществами Ca+ NH3=Ca(NH2)2 +H2 Ca+ H2O=Ca(OH)2+H2 Ca+ HCl=CaCl2+H2 любая кислота кроме азотной

Соединения кальция, стронция и бария применяют в разных отраслях промышленности и строительстве. Соединения кальция, стронция и бария применяют в разных отраслях промышленности и строительстве. Соединения стронция(нитрат, карбонат ,хлорид, оксалат) используют в производстве осветительных ракет, химического и термически устойчивого стекла. Оксид стронция входит в состав эмалей для защиты металлических предметов.

Презентацию выполнила учитель химии Тихомирова И.Ю. МОУ лицей № 20 г.Кострома Презентацию выполнила учитель химии Тихомирова И.Ю. МОУ лицей № 20 г.Кострома