Презентация на тему: Химия «Периодический закон»

Периодический закон. История открытия и возможности развития. Тюкова М.В. Учитель МБОУ СОШ №16 МО Северский район 2012год. Д.И. Менделеев 5klass.net

Актуальность В истории развития человеческих знаний немало великих подвигов. Но только очень немногих из них можно сопоставить с тем, что было сделано Дмитрием Ивановичем Менделеевым - одним из величайших деятелей мира. Научный подвиг Менделеева не имеет равных, величие его не только не стирается неумолимым временем, но продолжает расти. И никто не может сказать, будет ли когда-нибудь исчерпано до конца все содержание одного из величайших в науке обобщений периодический закон Менделеева. Минуло более ста лет со дня его открытия. История строго и придирчиво отбирает и сортирует все, что найдено и создано человеком. Поразительная, ставшая привычной четкость таблицы Менделеева из школьного учебника наших дней скрывает от нас гигантскую работу ученого по созданию всего, что было открыто до него о превращениях вещества, работу, посильную только гению, благодаря которой стала осуществимой великая догадка о существовании в мире нового закона - закона периодичности свойств химических элементов. Законы природы, открытые человеком различны по объему познанного, и по тому, в каких областях познания мира они действительны . Их трудно сравнивать между собой. Но законы сравнимы по главному смыслу - по возможности предсказания нового, предвидения неизвестного. Периодический закон не имеет себе равных в истории науки. Менделеев узнал путь направленного поиска в химии будущего. После Менделеева химики знали, где и как искать неизвестное. Много славных ученых основывались на периодическом законе, предсказывали и описывали неизвестные химические алименты и их свойства. Все предсказанное новые неизвестные элементы и свойства их соединений, законы их поведения в природе - все было неизвестно, все подтвердилось.

Объектом исследования является Периодическая система и Периодический закон Д.И. Менделеева Цель исследования: проследить историю открытия Периодического закона Содержание исследования : История науки не знает другого подобного триумфа. Открыт новый закон природы. Вместо разрозненных , не связанных между собой веществ в природе наукой встала единая стойкая система ,объединившая в одно целое все элементы вселенной. Но не только в открытии нового заключается научный завет, оставленный Менделеевым. Он поставил перед наукой еще более грандиозную задачу, объединив взаимную связь между всеми элементами, между их физическими и химическими свойствами. После открытия периодического закона стало ясно, что атомы всех элементов построены по единому плану, что их строение может быть только таким, какое определит периодичность их химических свойств. На развитие знаний о строении атома, о природе вещества закон Менделеева оказал огромное и решающие влияние . В свою очередь, успехи атомной физики, появление новых методов исследования, развитие квантовой механики расширило и углубило сущность периодического закона. Открытие периодического закона отмечалось во всем мире (1969).

В тот день Менделеев отложил свою поездку. Он написал на отдельных карточках все известные тогда элементы с их важнейшими химическими и физическими свойствами. Располагая эти карточки в различном порядке, сообразуясь с атомами всех элементов с их свойствами и со свойствами их соединений Менделеев составил свой первый вариант естественной системы химических элементов Но что же все-таки было сделано Менделеевым в этот исторический для науки день - 17 февраля 1869г. (1 марта по новому стилю)? На этот вопрос он ответ дал сам. Вот так, по его собственным словам, была открыта периодическая система: «…..Невольно зародилась мысль о том, что между массой и химическими свойствами, необходимо должна быть связь. А так как масса вещества, хотя и не абсолютная, а лишь относительная, выражается окончательно в виде весов атомов, то надо искать функциональное соответствие между индивидуальными свойствами элементов и их атомными весами. Искать же, что-либо, хотя бы грибы или какую-нибудь зависимость, нельзя иначе, как смотря и пробуя. Вот я и стал подбирать на отдельных карточках элементы с их атомными весами и конкретными свойствами, сходные элементы и близкие атомные веса, что быстро и привело к тому заключению, что свойства элементов стоят в периодической зависимости от их атомного веса, причем, сомневаясь во многих неясностях, я ни минуту не сомневался в сделанном выводе, так как случайность допустить было невозможно».

Этот небольшой листок обычной писчей бумаги относится к числу наиболее ценных документов в истории человечества. Ныне он хранится музее – архиве Д.И. Менделеева при Санкт - Петербургском университете. Ученый отпечатал в типографии оттиски с заявлениями на русском и французском языках и разослал своим отечественным и зарубежным коллегам. Внизу оттиска на французском языке стояла дата по европейскому календарю «1.03.69». Вот почему вероятно, с ней и стали связывать открытие периодического закона. Первое сообщение о величайшем открытии было сделано 6 марта 1869г., на заседании Русского химического общества. Менделеева на заседании не было. Вместо автора его доклад прочел Меншуткин. В протоколах Русского химического общества появилась сухая запись о собрании 6 марта 1969г., Н. Меншуткин сообщает от имени Д. И.Менделеева опыт системы элементов, основанный на их атомном весе, химическом сходстве. За отсутствием Д. Менделеева обсуждения этого сообщения отложено до следующего заседания. Этот сухой канцелярский протокол стал историческим документом огромной важности - свидетельством о первом знакомстве человечества с новым законом природы, который перевернул впоследствии весь ход развития научной мысли. Но нужно признать, что научные, современники Менделеева, впервые услышали и узнали об этой периодической системе элементов, не смогли её сразу понять , они остались к ней равнодушными.

Кабинет Д.И. Менделеева

Домовая книга Автограф полной таблицы элементов Д.И. Менделеева, переписанной набело для отправки в типографию 17 февраля 1869 г. Листок с «Опытом системы элементов» Д.И. Менделеева отпечатан. На французском языке для рассылки иностранным ученым

А было, ли все так просто, как рассказывал сам Менделеев? На первый взгляд и в самом деле нет ничего трудного в том, чтобы, написав на отдельных карточках названия элементов, их атомные веса и свойства, расположить их по порядку. Ведь из всех способов, какими можно было комбинировать эти карточки, наиболее простой расположить их в ряд по возрастанию атомного веса, начиная с элемента с наименьшим весом. Это, конечно, первое, что должно прийти в голову каждому. Подметить же закономерность в изменении свойств правильно расположенных элементов не так должно быть трудно. Ведь эти свойства во времена Менделеева были хорошо известны. В чем же заслуга Менделеева? Давайте условимся на некоторое время забыть все, что мы успели узнать в школе о периодической системе, вообразим, что мы перенеслись в середину прошлого века и можем знать только то, что знали современники Менделеева. К этому времени было открыто и изучено примерно шестьдесят химических элементов. Свыше тридцати элементов было еще неизвестно, и об их существовании никто тогда и подозревать не мог. Уже были найдены способы определения атомной массы (но здесь мы будем называть эту величину по–старому - атомный вес, как ее называл сам Менделеев). Измеряли атомный вес еще грубо, с малой точностью, и далеко не для всех элементов правильно. Для химиков времен Менделеева это была еще очень трудная задача. Неверно были определены атомные веса у многих элементов, причем, конечно, об этом тоже никто не подозревал. Как же должен был бы расположить свои карточки Менделеев? Самый малый атомный вес у водорода (H), он равен 1. Следующим по порядку был в то время литий (Li). Его атомный вес около 7. За ним шел бор (В) с атомным весом около 11.

Далее углерод ( С) с атомным весом 12, азот (N) с атомным весом 14 , бериллий (Be) с атомным весом тоже 14, затем кислород (О) , атомный вес которого равен 16, фтор ( F) с атомным весом 19 и т.д. Следовательно, в 1869 г. любой химик, желая расположить карточки с написанными на них обозначениями элементов, их атомными весами и химическими свойствами по возрастанию атомного веса, должен был составить вот такой ряд: H Li B C N Be O F Na Mg Al Si P S Cl 1 7 11 12 14 14 16 19 23 24 27 28 31 32 35 На этих карточках написаны округленные атомные веса с точностью, с какой они были известны химикам в 1869 г. А как расположил Менделеев свои карточки с элементами? Конечно, на первой карточке Менделеева тоже были написаны название , атомный вес и свойства водорода. Вторую карточку с атомным весом и свойствами металла лития он поместил под карточкой водорода. На третье место рядом с литием Менделеев положил карточку, на которой было написано: Ве 9 Хотя в те времена большинство химиков были твердо уверены ( в соответствии со всеми данными химии бериллия), что должно было быть помечено: Ве 14 Почему же Менделеев, не проводя сам никаких новых исследований, не определяя атомный вес - важнейшую и , казалось бы, уже твердо установленную

характеристику химического элемента? Ведь он сам никогда не занимался научными исследованиями в области химии бериллия. На четвертое место Менделеев поместил карточку бора. Пятое место занял у него углерод. На шестом месте - азот, далее следовали кислород и фтор. Девятая карточка, принадлежащая металлу натрию, была им помещена под второй, на которой были записаны химические характеристики металла лития. По порядку следующее место занял магний, за ним - алюминий. Под углеродом оказался кремний, под кислородом - сера, под фтором - хлор. Вот как Менделеев расположил свои карточки с названиями и свойствами элементов вначале своей таблицы: Н 1 Li Be B C N O F 7 9 11 12 14 16 19 Na Mg Al Si P S Cl 23 24 27 28 31 32 35 Итак, в вертикальных рядах оказались химически сходные элементы. Металл литий похож на металл натрий: оба мягкие , легко режутся ножом, бурно реагируют с водой, образуя щелочи. Бериллий и магний схожи друг с другом. У фтора много общего с хлором - это едкие удушливые газы, которые образуют с металлами совершенно сходные соединения. И каждый химик знает, что свойства кислорода и серы сходны между собой. При таком расположении совершенно четко проявилась периодичность свойств у элементов. В двух первых коротких периодах менделеевской таблицы правильно чередуются элементы с аналогичными свойствами. Как же все-таки эти периоды были построены Менделеевым? Пожалуй, он был не прав, когда утверждал, что расположил элементы по их атомному весу. Если бы он действительно расположил их по возрастанию тех атомных весов, которые были известны науке в то время,

то никакого периодического закона обнаружить было бы невозможно даже в первых рядах таблицы. Скорее наоборот, Менделеев установил на основании периодического закона правильный атомный вес бериллия. Позднейшие исследования подтвердили это предсказание. Если исходить из атомных весов, известных в середине прошлого века, то следующие два горизонтальных ряда элементов, идущих за хлором, надо было бы построить так: K Ca V Cr Ti Mn Fe Co 39 40 51 52 52 55 56 59 Ni Cu Zn As Se Br 59 63 65 75 78 80 Но, продолжая построение своей таблицы, Менделеев разместил карточки совсем не так. Под карточкой натрия была помещена карточка с очень похожим на натрий калием, и калий стал началом нового ряда. Под магнием тогда оказался тоже очень сходный с ним кальций. Следующим, в порядке возрастания атомного веса, должен был быть ванадий, но его карточка пока отложена в сторону, а вместо нее рядом с кальцием Менделеев кладет пустую карточку. С точки зрения химика прошлого столетия это непонятный и ничем не оправданный поступок. Вслед за пустой карточкой можно было ждать, что будет положена карточка ванадия. Но вместо ванадия на следующем месте оказывается титан, у которого Менделеев осмеливается, не проводя сам никаких исследований, вопреки всему, что известно о титане всем химикам во всем мире, изменить произвольно его атомный вес с 52 на 48. После чего, наконец, за титаном следует карточка ванадия, и только за ней идут карточки хрома и марганца.

Как же все-таки располагал свои карточки Менделеев? Ведь и в этом ряду таблицы он разместил элементы вопреки возрастанию известных в то время атомных весов. Прежде чем поместить карточку титана в таблицу, Менделеев, по существу, предсказал истинное знание его атомного веса так же, как это сделал для бериллия. Этот период в таблице Менделеева длинный. За марганцем идут железо (Fe)-56, кобальт(Co)-59, никель(Ni)-59, далее медь (Cu)-63, цинк(Zn)-65. Но вслед за цинком ученый снова оставил в своей таблице подряд два пустых места. Далее следовали карточки с хорошо известными элементами - мышьяком, селеном и карточка с бромом, завершающая длинный период. При этом карточки мышьяка, селена и брома оказались лежащими под сходными с ними элементами конца предающего короткого периода: фосфором, серой и хлором. H 1 Li Be B C N O F 7 9 11 12 14 16 19 Na Mg Ai Si P S CI 23 24 27 28 31 32 35 K Ca ? Ti V Cr Mn Fe Co Ni 39 40 48 51 52 55 56 59 59 Cu Zn ? ? As Se Br 63 65 75 78 80 Из того, что мы разобрали, совершенно очевидно, что дело обстояло далеко не так просто, как скромно рассказывал сам Менделеев. Одних только фактов, которые были известны химикам до Менделеева, как бы их ни комбинировать, не было достаточно, чтобы открыть один из величайших знаков природы - периодический закон. Нужно было не только знать накопленный в течении многих веков химический опыт. Надо было обладать гениальностью и особенно тонкой интуицией, чтобы охватить всю необозримую совокупность бесчисленного множества химических явлений и глубоко почувствовать скрытую в них закономерность.

Нужно было обладать особой революционной смелостью, чтобы осознав эту закономерность, исправлять старое и предсказывать новое в науке. Что же означают пустые места в таблице Менделеева? Может быть, это пробелы в природе, и потому химики не нашли элементы, подходящие к пустым клеткам таблицы? Или это пробелы в человеческом знании о природе? Существует ли, например, элемент, атомный вес которого больше, чем у кальция, и меньше, чем у титана, и в то же время похожий химическими свойствами на бор и алюминий? У Менделеева сомнений не было. Каждое место в таблице соответствует определенному химическому элементу, который должен обязательно существовать. Места, на которых были расположены карточки с названиями элементов, клетки в периодической таблице, где вписаны символы элементов и их атомные веса, для великого ученого были полны глубочайшего содержания: они определяли всю природу каждого элемента, все его физические и химические свойства и свойства всех его соединений. В 1871г. в журнале Русского химического общества появилась большая работа Менделеева. Она называлась «Естественная система элементов». Вряд ли в мировой научной литературе когда -либо была опубликована статья, похожая на эту! В ней Менделеев описал три никем, никогда и нигде в мире не виданных химических элемента, как не смог бы это сделать иной ученый- исследователь, державший в руках их соединения и посвятивший долгие годы опытному изучению их в лаборатории. Во всей истории науки трудно найти что-либо равное этому необычному выступлению русского химика - не только по научной смелости, по революционной глубине влияния этой статьи на развитие не только химии, но и всей науки в течение столетия, вплоть до наших дней. «Решаюсь сделать это ради того, чтобы хотя со временем, когда будет открыто одно из этих предсказываемых мной тел, иметь возможность окончательно увериться самому и уверить других химиков в справедливости тех предложении, которые лежат в основании предлагаемой мною системы», - писал в этой статье Менделеев.

Каким же путем периодический закон дает возможность описать неведомое? Каким образом место в таблице определяет свойства элемента? Лучше всего это можно понять, если попытаться, по примеру Менделеева, сравнить свойства элемента пустой клетки со свойствами его соседей. Выделим из таблицы ту часть, которая включает пустые места и окружающие их элементы. Пустая клетка между кальцием и титаном находится в начале четвертого периода, а две пустые клетки, расположенные рядом между цинком (Zn) и мышьяком (As), находятся в конце этого периода. Гипотетический (предлагаемый) элемент, который должен был занимать первое пустое место, Менделеев назвал экабором. В таблице он следует за кальцием. Тот элемент, который должен занять пустое место около цинка, Менделеев назвал экаалюминием, а соединения с ним- экасилицием. 2 3 4 5 Be B C N 2 9 11 12 14 Mg AI Si P 3 24 27 28 31 Ca ? Ti V 40 48 51 4 Zn ? ? As 65 75 Sr Y Zr Nb 88 89 91 94 5 Cd In Sn Sb 112 114 119 120 Пустое место экабора находится между кальцием (атомный вес 40) и титаном (атомный вес 48). Следовательно, атомный вес экобора должен быть близок к среднему значению: 40+48 4 / 2 = 48

С кислородом он должен давать окись, аналогичную по составу с окисями брома и алюминия .Сам экабор должен быть легким металлом: он ведь стоит между двумя легкими металлами - кальцием и титаном. Относительная плотность соседей экобара по ряду позволяет определить и его относительную плотность. Для кальция она равна 1,6 для титана - 5,2. Поэтому относительная плотность экабора должна быть приблизительно равна. 1,6+5,2 / 2 =3,4 У экабора должны быть бесцветные соли, потому что соседи образуют бесцветные соединения. Из растворов его солей экаборов можно осаждать содой, его углекислая соль будет нерастворимой, потому что его соседи образуют нерастворимые соли. Попробуем описать и еще один элемент, пустое место которого находится рядом с цинком - экаалюминий. Между цинком и мышьяком Менделеев оставил два пустых места. Атомный вес мышьяка - 75, цинка-65. Нетрудно сообразить, что экаалюминий должен обладать атомным весом около 68. Он помещается в третьем столбе рядом с металлом цинком; в этот столбе находится алюминий - тоже металл, и экаалюминий должен быть на него похожим. Значит, экаалюминий будет тоже металлом. Плотность его мы определили бы по известной плотности ближайших соседей, учитывая лишь, что рядом с экаалюминием есть еще одно пустое место - экасилиций. Относительная плотность экаалюминия должна быть близка к 6,0. Так же как и экабор, экафлюминий можно осадить содой из растворов его солей. Соединения алюминия с хлором обладают при высокой температуре летучестью, и хлористое соединение экаалюминия должно быть также летучим. Вот какими словами Менделеев заканчивает описание свойств экаалюминия: «Можно надеется, что он будет открыт спектральным исследованием, подобно тому как открыты следующее за ним индий и таллий…»

Таким образом, Д.И. Менделеев не только описал неведомое, но и предсказал, как оно будет показано. Как оправдывались предсказания Менделеева? Не прошло и шесть лет, как весь мир облетело известие: в 1875г. молодой французский ученый- спектроскопист Лекок де Буабодран выделил из минерала, добытого в Пиренейский горах, новый элемент. Буабодрана навела на след слабая фиолетовая линия в спектре минерала, которую нельзя было приписать ни одному из известных химических элементов. В честь своей родины, которая в древности называлась Галлией, Буабодран назвал новый элемент галлием. Галлий - очень редкий металл, и Буабодрану стоило большого труда добыть его в количестве немногим больше булавочной головки. Но Буабодран оказался большим искусником. Он ухитрился с этой крупинкой проделать много интересных опытов и подробно описал плотность гелия, температуру плавления, получить соединения с кислородом и даже соли. Каково же было удивление Буабодрана, когда через Парижскую академию наук он получил письмо с русской маркой, в котором сообщались: в описании свойств галлия все верно, за исключением плотности: галлий тяжелее воды не в 4,7 раза, как утверждал Буабодран, а в 5,9 раза. Неужели кто-то другой открыл галлий раньше? Буабодран заново определил плотность галлия, подвергнул металл более тщательной очистке. И оказалось, что он ошибся, а автор письма - это был, конечно, Менделеев, который и не видел галлия, - прав: относительная плотность галлия не 4,7 а 5,9. Еще через 4 года, в 1879г. шведский химик Нильсон нашел новый неизвестный элемент в редком минерале гадолините. Его назвали скандием. Когда же были изучены его свойства, стало совершенно очевидно, что это не что иное, как давно известный, по предсказанием Менделеева, экабор.

А через 15 лет после предсказания Менделеева (в 1886г.) немецкий химик Винклер открыл новый элемент и назвал его германием. На этот раз Менделееву не пришлось самому указывать, что и это вновь открытый элемент был им предсказан ранее. В своем сообщении Винклер отметил, что его германий полностью соответствует экасилицию Менделеева. Он писал в своей работе: «Едва ли можно найти иное более поразительное доказательство справедливости учения о периодичности, как во вновь открытом элементе. Это не просто подтверждения смелой теории, здесь мы видим очевидное расширение химического кругозора, мощный шаг в области познания». Винклер не искал германий по приметам, опубликованным Менделеевым. Он наткнулся на него случайно. Получилось так, что еще не открытые химические элементы как бы взяты на учеты: их столько, сколько пустующих клеток в периодической таблице Менделеева. Приметы каждого из них в точности известны, и даже можно предсказать заранее, в каких минералах нужно их искать, какими химическими способами следует извлекать эти элементы из минералов, в которых они скрываются. Существование в природе более десяти новых, не известных никому элементов предсказал сам Менделеев. Для десятка элементов он предсказал правильные атомные веса. Все последующее поиски новых элементов в природе велись исследователями при помощи периодического закона. Этот закон не только помогал ученым в поисках истины, но и способствовал исправлению ошибок и заблуждений в науке. В 1864г. был «открыт» элемент «ильмений». Для него был установлен атомный вес 114. По некоторым свойствам он был похож на марганец. Казалось, что его следует поместить в свободную клетку таблицы, где должен был находиться предсказанный Менделеевым экамарганец. Но Менделеев отказался это сделать. Он заявил, что «ильмений» своими свойствами не соответствует требованиям периодического закона, и что такой элемент существовать в природе не может.

«Открытие» «ильмения» просто ошибка. Менделеев оказался прав. Вскоре было доказано, что такого элемента в природе нет. 26 октября 1868г. на заседании Парижской академии наук были прочитаны одно за другим два письма. Одно было прислано из Индии, от французского астронома Жансена, другое - из Англии, от английского астронома Локьера. Оба сообщали, что в спектре солнечных протуберанцев они (независимо друг от друга) обнаружили новую желтую линию, которая не может принадлежать ни одному химическому элементу из существующих на земном шаре. Было решено, что новая линия в спектре принадлежит какому-то особому «небесному» элементу. Он был назван древнегреческим именем Солнца - гелий. Спустя 25 лет после открытия гелия на Солнце знаменитый английский физик Джон Рэлей обнаружил очень странный факт: плотность чистого азота, добытого из воздуха, больше плотности того же азота, полученного из любого азотного соединения. Разница была ничтожна - тысячные доли грамма на литр, но она была. Рэлей написал об этом письмо в лондонский журнал «Природа». Он спрашивал , не сумеет ли кто -нибудь из читателей журнала объяснить, почему «воздушный» азот тяжелее. Но ответов не последовало. Тогда Рэлей обратится к своему другу - известному английскому химику Рамзаю, и они решили, что каждый из них не покинет свою лабораторию, пока загадка не будет разгадана. Они работали разными методами и, наконец, нашли, что в обычном воздухе существует какая-то примесь, и не малая. Они дали ему имя аргон. Странный это был газ. Подобных веществ химики еще не знали. Никакими средствами им не удавалось заставить его вступать в химическими реакции. Это и было выраженно в его названии: по-гречески «аргон» негорючий газ. Рамзай решил проверить, не аргон ли это.

Но газ, выделявшейся из минерала клевеита, оказался не аргон. У него был совершенно другой спектр, отличный от уже изученного спектра аргона. Рамзай дал ему имя «криптон» («тайный») и послал запаянную пробирку с «криптоном» одному из опытных спектроскопистов английскому химику и физику Круксу для точного исследования спектра. В ответ он получил телеграмму: «Криптон - это гелий. Приходите и поглядите Крукс». Так газ, впервые за четверть века до этого найденный на Солнце, был наконец обнаружен на Земле. Гелий оказался самым легким газом после водорода. Но периодический закон не предусматривал существования таких химических элементов, как гелий и аргон. Для них в периодической системе не было пустых клеток. Куда же поместить новые элементы? Скептики снова воспрянули духом, снова зазвучали голоса сомневающихся в периодической системе и периодическом законе. Но это продолжалось недолго. В 1897г. Рамзай прочел доклад, который он озаглавил так: «Еще не открытый газ». Рамзай сказал: «По образу нашего учителя Менделеева я описал, поскольку возможно было, ожидаемые и предполагаемые соотношения газообразного элемента, который должен был бы заполнить пробелы между гелием и аргоном». Места для гелия и аргона в таблице нашел Рамзай. Они были помещены в новый, нулевой, столбец между седьмым, где были фтор и хлор, и первым, где разместились металлы, подобные литию и калию. Отсюда следовало, что должен существовать газ, столь же интересный, как аргон, но легче его - с атомным весом 20. Руководствуясь предсказанными свойствами, Рамзай предпринял поиски нового газа и нашел его в сжиженном воздухе. Этот газ получил названия «неон», что значит «новый», а вскоре были найдены и остальные элементы новой группы: криптон, ксенон и затем радон.

H He Li 1 4 7 F ? Na 19 20 23 CI Ar K 35,5 38 39 Br ? Rb 80 82 85 J ? Cs 127 128 133 Из того испытания периодический закон вышел с победой. Иначе и не могло быть! После этого ни у кого в мире не оставалось сомнения в истинности периодического закона Менделеева. Этот успех был заслуженным. Великий закон доказал единство вещества во Вселенной. Он внес стройность и порядок в невообразимую путаницу бесчисленного множества факторов, наблюдений, измерений, накопленных химией к середине прошлого века за сотни лет. Он дал могучий метод для изучения химических элементов и их свойств. Сам Менделеев исправил атомные веса многих элементов, известных ранние, в том числе, например, урана. Периодический закон дал возможность предсказывать новое - это истинный закон природы. Но не все было ясно в периодическом законе. Были необъяснимые исключения: атомный вес аргона(39,9) оказался большим, чем атомный вес калия(39,1), а аргон в таблице стоит перед калием. Атомный вес кобальта превышал атомный вес никеля, хотя по свойствам кобальт в периодической системе должен был предшествовать никелю. И у теллура, стоящего перед йодом, атомный вес оказался больше, чем у йода. Не только это было неясным в таблице. Было твердо установлено, сколько должно быть элементов в первых периодах таблицы, но оставалось совершенно неясным, сколько элементов должно быть в ее последних периодах.

Самое же главное, что же было неясным - это сам периодический закон. Он требовал от науке решить величайшую, казалось бы, неразрешимую задачу: объяснить периодичность химических свойств у элементов, из, которых состоит весь окружающий нас мир. Научные работы Менделеева были тесно связаны с практической деятельностью. По его инициативе стали строить нефтепроводы, он предложил использовать нефть как химическое сырье. Развитие промышленности он считал условием независимости России. Особое внимание он уделял нефтяной, угольной, металлургической и химической промышленностям. Менделеев предлагал энергичнее осваивать природные богатства Донбасса, Урала и Кавказа. Он считал, что это приведет к увеличению производства чугуна, стали, меди. С открытия периодического закона начинается современный этап развития химической науки. До этого химия представляла собой скопление разрозненных, обрывочных, лишенных внутренней связи фактов, теперь же она стала целостной наукой, разнообразное содержание которой объединено в стройную систему. Периодический закон и его выражение — Периодическая система — обобщают и систематизируют сведения о химических элементах и образуемых ими соединениях. Зная положение элемента в Периодической системе, вы можете охарактеризовать как сам элемент, так и его соединения. Как любой закон природы, периодический закон и Периодическую систему используют для объяснения фактов и явлений. На основе строения атома вы можете объяснить взаимосвязь строения и свойств химических элементов, закономерности изменения их свойств, причину периодичности изменения свойств элементов и их соединений. Благодаря периодическому закону стало возможным не только классифицировать уже известные элементы, но и исправлять относительные атомные массы элементов и предсказывать (прогнозировать) свойства элементов, которые еще не открыты.

Тайна периодической системы элементов была разгадана, когда удалось понять сложнейшую структуру атома, строение его внешних электронных оболочек, законы движения электронов вокруг положительно заряженного ядра, в котором сосредоточена почти вся масса атома. Сотни и тысячи талантливых и самоотверженных ученых трудились, выясняя структуру атома. Они шли к ней разными путями и с разных сторон. Теоретики и экспериментаторы, физики и химики, открывая новые факты, отыскивая новые закономерности, всегда сопоставляли свои результаты и выводы с системой Менделеева. Долгим и трудным путем шла наука к разгадке великой тайны периодического закона. Он воплотил в себе все необозримое многообразие бесконечного множества химических процессов и превращений в окружающем нас мире. Он внес ясность и порядок в химию, где до него царствовал хаос отрывочных и несвязанных сведений, фактов, наблюдений, накопленных многими поколениями химиков. Почему элементы так послушно повинуются закону Менделеева? Почему существует таинственная правильная повторяемость свойств у химических элементов? Почему натрий похож на калий, а фтор сходен с хлором? Почему кислород и сера присоединяют по два атома водорода, а атомы углерода и кремния образуют соединения, в которых по четыре водородных атома? Почему химик, хорошо изучивший таблицу Менделеева, заранее скажет, какие соединения могут возникнуть при взаимодействии различных элементов? Какова таинственная причина этих по истине удивительных закономерностей, управляющих течением всех химических реакций между всеми элементами, дающих бесчисленное множество соединений, из которых состоят все тела в окружающем нас мире, не только на нашей Земле, но и далеко за ее пределами, в безграничном космосе.

Много, очень много можно задать подобных вопросов. Ответ на них один. Все химические и физические свойства вещества определяются строением атомов. Великий закон, открытый Менделеевым, потому и есть всеобщий закон природы, что он выражает закон строения атома.

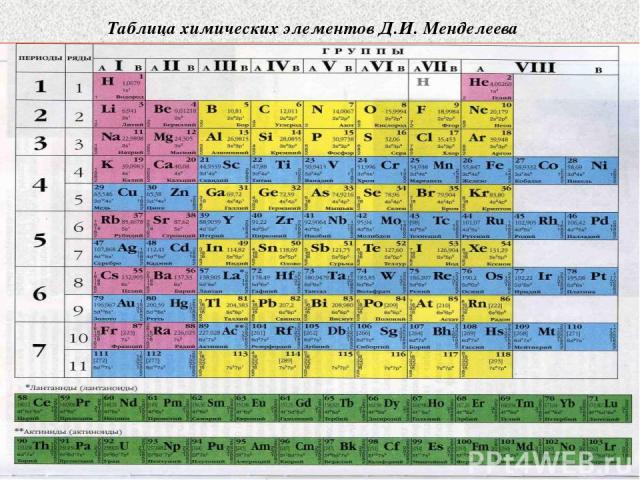
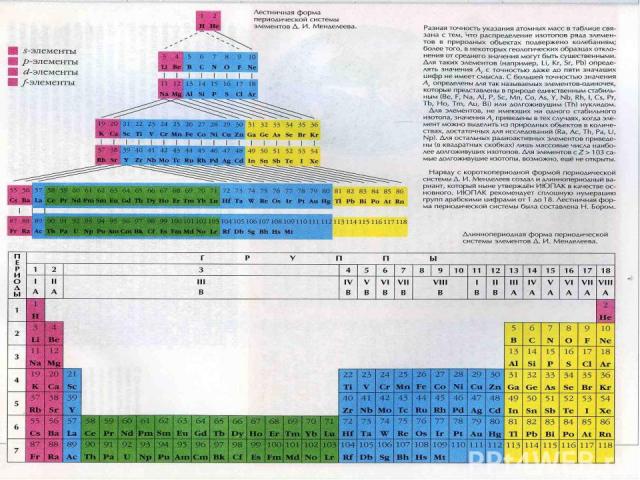
Таблица химических элементов Д.И. Менделеева

Литература: 1. Школьная энциклопедия «Руссика». История России. 18-19 вв.- М.Олма-Пресс образование. 2003-736 с.. ил. Том «история России. 18-19 вв.» .Школьной энциклопедии «Руссика» содержит сведения о событиях и исторических лицах Российской империи в 18-19 вв. В издании свыше 1500 иллюстраций, карт, схем. 2. Детская энциклопедия. Том 3. Вещество и энергия/ науч. Ред. Петрянов И.В.-М.: Педагогика 1973-544 с. 3. Энциклопедия для детей Том 17. Химия/ глав.ред. В.Володин. вед. науч. ред. И.Леенсон –М.: Аванта, 2004-640с: ил. 4. Химия 9 класс: Учебник для общеобразовательных учебных заведений/ И.И. Новошинский, Н.С. Новошинская – М.: ООО «Издательский дом «ОНИКС 21 век»: ООО «Издательство « Мир и Образование», 2003 -256 с: ил. 5. Петров А.А. Справочник по химии для школьников – М. Лист Нью, 2003-432 с.