Презентация на тему: Азотная кислота и её свойства

900igr.net

Индивидуальная работа Осуществите превращения 1 вариант: N2 → NO→NO2 2 вариант: N2→NH3→(NH4)SO4 3 вариант: NH3→N2→K3N


Содержание Структурная формула Физические свойства Химические свойства Получение азотной кислоты
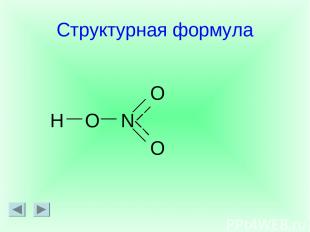
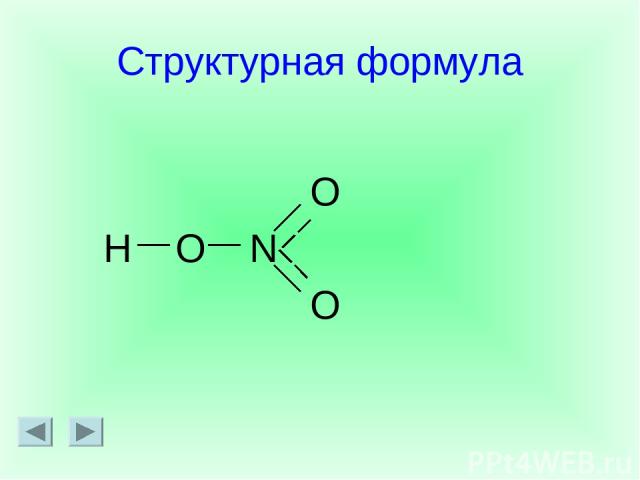
O H O N O Структурная формула

ФИЗИЧЕСКИЕ СВОЙСТВА Бесцветная жидкость с едким запахом. Гигроскопична, дымит на воздухе. Смешивается с водой в любых соотношениях. Температура кипения 86°С.

ХИМИЧЕСКИЕ СВОЙСТВА - Общие с другими кислотами - Специфические свойства

Разбавленная азотная кислота проявляет все свойства кислот: 1. в водных растворах диссоциирует 2. взаимодействует с основными оксидами 3. взаимодействует с основаниями

Азотная кислота проявляет особые свойства: Взаимодействие с металлами Взаимодействие с неметаллами Взаимодействие с органическими соединениями

Взаимодействие с металлами В таких реакциях водород, как правило, не выделяется: он окисляется, образуя воду. Кислота, в зависимости от концентрации и активности металла, может восстанавливаться до соединений: NO2 HNO2 N2O N2 NH3(NH4NO3)

Концентрированная HNO На Fe, Cr, Al, Au, Pt, Ir, Ta не действует С другими тяжелыми металлами – выделяется NO2 Ag + 2HNO3(конц) = AgNO3 + NO2 + H2O С щелочными и щелочноземельными металлами – выделяется N2O 4Na + 6HNO3(конц) = 4NaNO3 + N2O + 3H2O 3

Разбавленная HNO С тяжелыми металлами – выделяется NO 3Ag + 4HNO3(разб) = 3AgNO3 + NO + 2H2O С щелочноземельными металлами ,а также с Zn, Fe – выделяется NH3 4Zn + 10HNO3(разб) = 4Zn(NO3)2 + 2NH3 + 2H2O 3

Взаимодействие с неметаллами Азотная кислота взаимодействует со многими неметаллами, окисляя их до соответствующих кислот: S + 2HNO3 = H2SO4 + 2NO 3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO C + 4HNO3 = CO2 + 2H2O + 4NO2

Взаимодействие с органическими соединениями С белками – появление ярко-желтого окрашивания С бензолом – получение взрывчатых веществ

Производство азотной кислоты Получение: Лабораторный способ В лаборатории азотную кислоту получают NaNO3 + Н2SO4 = NaНSO4 + НNO3

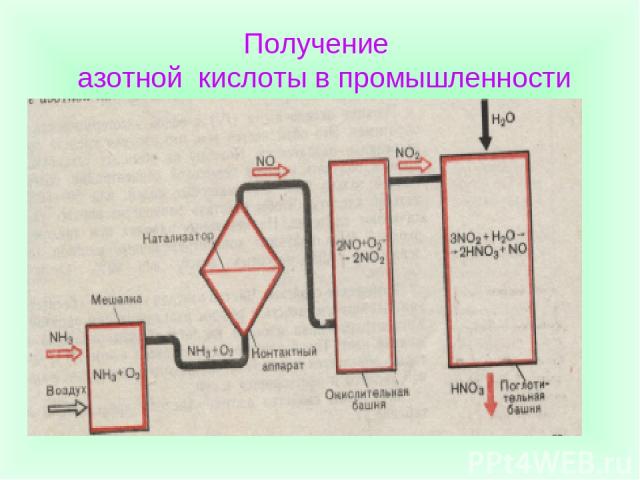
Промышленный способ получения азотной кислоты Получение азотной кислоты окислением аммиака кислородом воздуха
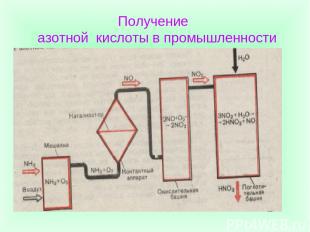
Получение азотной кислоты в промышленности
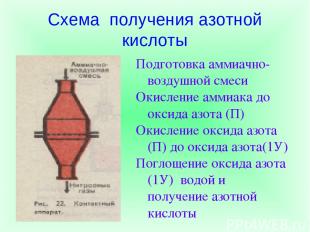
Схема получения азотной кислоты Подготовка аммиачно-воздушной смеси Окисление аммиака до оксида азота (П) Окисление оксида азота (П) до оксида азота(1У) Поглощение оксида азота (1У) водой и получение азотной кислоты

Химические реакции получения азотной кислоты в промышленности Подготовка аммиачно-воздушной смеси 2 Окисление аммиака до оксида азота (П) 3 Окисление оксида азота (П) до оксида азота(1У) 4Поглощение оксида азота (1У) водой и получение азотной кислоты

Домашнее задание: §19.8 выписать: Записать уравнения реакций распознавания нитратов

Проверь себя: Закончите высказывание: 1. Формула азотной кислоты ... 2. Ее получают в промышленности из ... 3. Азотная кислота применяется для получения ... 4. Азотная кислота является... электролитом и взаимодействует с ... 5. Особым свойством азотной кислоты является взаимодейст вие с .... При данных реакциях газ ... никогда не выделяется. 6. Соли азотной кислоты - .... Они используются как .... 7. Распознать соли азотной кислоты можно с помощью ... и ... . Признак реакции -....