Презентация на тему: Азотная кислота

Азотная кислота1. Состав. Строение. Физические свойства2. Классификация3. Получение азотной кислоты4. Химические свойства 5. Применение Соли азотной кислотыТест
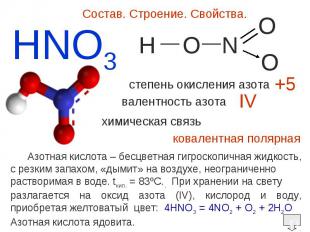
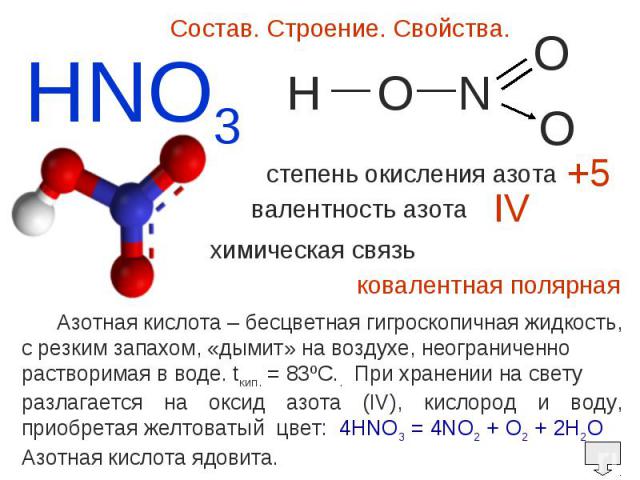
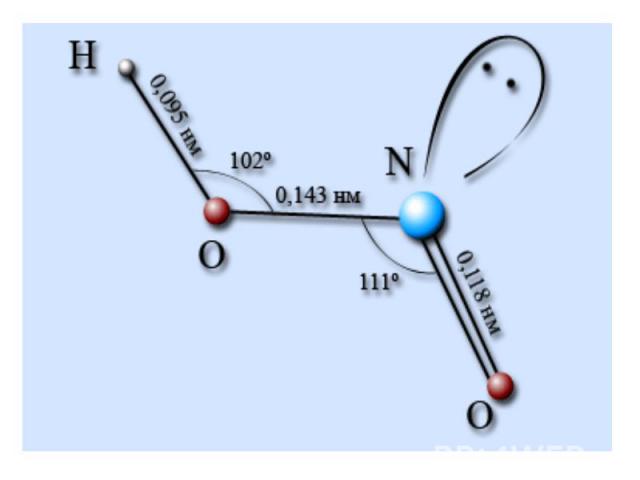
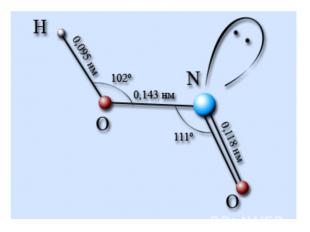
Состав. Строение. Свойства. Азотная кислота – бесцветная гигроскопичная жидкость,c резким запахом, «дымит» на воздухе, неограниченно растворимая в воде. tкип. = 83ºC.. При хранении на свету разлагается на оксид азота (IV), кислород и воду, приобретая желтоватый цвет: 4HNO3 = 4NO2 + O2 + 2H2OАзотная кислота ядовита.

При разложении азотной кислоты выделяется кислород, поэтому скипидар вспыхивает.

Азотная кислота (HNO3) КлассификацияАзотная кислота по:наличию кислорода:основности:растворимости в воде:летучести:степени электролитической диссоциации:кислородсодержащаяодноосновнаярастворимаялетучаясильная

Получение азотной кислоты в промышленности1. Контактное окисление аммиака дооксида азота (II): 2. Окисление оксида азота (II) в оксидазота (IV): 3. Адсорбция (поглощение) оксидаазота (IV) водой при избытке кислорода

В лаборатории азотную кислоту получают действием концентрированной серной кислоты на нитраты при слабом нагревании.Составьте уравнение реакции получения азотной кислоты.NaNO3 + H2SO4 = NaHSO4 + HNO3

Химические свойства азотной кислоты1. Типичные свойства кислот2. Взаимодействие азотной кислоты с металлами3. Взаимодействие азотной кислоты с неметаллами

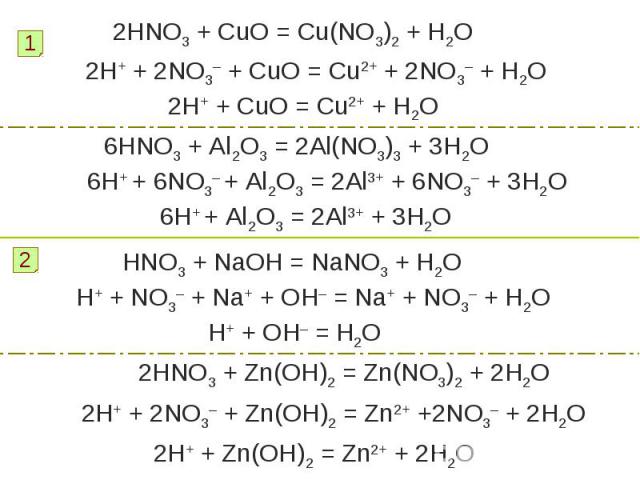
Химические свойства азотной кислотыАзотная кислота проявляет все типичные свойства кислот.Перечислите свойства характерные для кислот. Кислоты взаимодействуют с основными и амфотерными оксидами, с основаниями, амфотерными гидроксидами, с солями. Составьте уравнения реакций азотной кислоты: с оксидом меди (II), оксидом алюминия;c гидроксидом натрия, гидроксидом цинка; c карбонатом аммония, силикатом натрия.Рассмотрите реакции с т. зр. ТЭД.Дайте названия полученным веществам. Определите тип реакции.
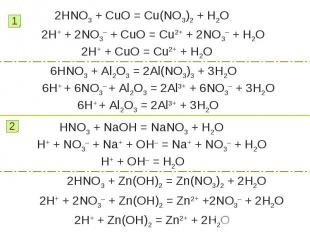
2HNO3 + CuO = Cu(NO3)2 + H2O2H+ + 2NO3– + CuO = Cu2+ + 2NO3– + H2O2H+ + CuO = Cu2+ + H2O6HNO3 + Al2O3 = 2Al(NO3)3 + 3H2O6H+ + 6NO3– + Al2O3 = 2Al3+ + 6NO3– + 3H2O6H+ + Al2O3 = 2Al3+ + 3H2OHNO3 + NaOH = NaNO3 + H2OH+ + NO3– + Na+ + OH– = Na+ + NO3– + H2OH+ + OH– = H2O2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O2H+ + 2NO3– + Zn(OH)2 = Zn2+ +2NO3– + 2H2O2H+ + Zn(OH)2 = Zn2+ + 2H2O
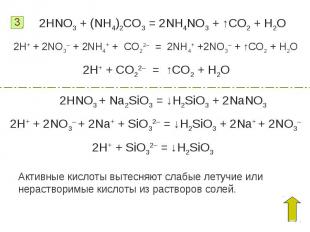
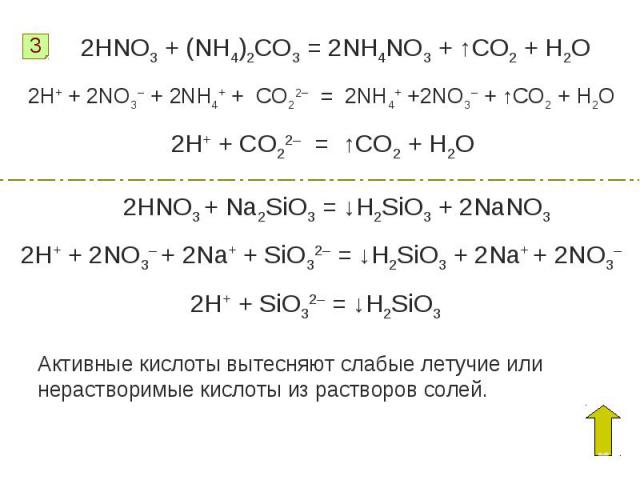
2HNO3 + (NH4)2CO3 = 2NH4NO3 + ↑CO2 + H2O2H+ + 2NO3– + 2NH4+ + CO22– = 2NH4+ +2NO3– + ↑CO2 + H2O2H+ + CO22– = ↑CO2 + H2O2HNO3 + Na2SiO3 = ↓H2SiO3 + 2NaNO32H+ + 2NO3– + 2Na+ + SiO32– = ↓H2SiO3 + 2Na+ + 2NO3–2H+ + SiO32– = ↓H2SiO3 Активные кислоты вытесняют слабые летучие или нерастворимые кислоты из растворов солей.

Взаимодействие азотной кислоты с металламиКак реагируют металлы с растворами кислот? Особенности взаимодействия азотной кислоты с металлами:1. Ни один металл никогда не выделяет из азотной кислоты водород. Выделяются разнообразные соединения азота: N+4O2, N+2O, N2+1O, N20, N–3H3 (NH4NO3)2. С азотной кислотой реагируют металлы, стоящие до и после водорода в ряду активности.3. Азотная кислота не взаимодействует с Au, Pt4. Концентрированная азотная кислота пассивирует металлы:Al, Fe, Be, Cr, Ni, Pb и другие (за счет образования плотной оксидной пленки). При нагревании и при разбавлении азотной кислоты данные металлы в ней растворяются.

Окислительные свойства азотной кислоты

Составьте уравнение реакции взаимодействия концентрированной азотной кислоты с ртутью. Рассмотрите реакцию с т. зр. ОВР. 4HN+5O3 + Hg0 = Hg+2(NO3)2 + 2N+4O2 + 2H2ON+5 + 1e → N+4 1 2Hg0 – 2e → Hg+2 2 1HNO3 (за счет N+5) – окислитель, процесс восстановления;Hg0– восстановитель, процесс окисления.

Допишите схемы реакций:1) HNO3(конц.) + Cu → Cu(NO3)2 + … + H2O2) HNO3(разб.) + Cu → Cu(NO3)2 + … + H2O Рассмотрите превращения в свете ОВР1) HN+5O3(конц.) + Cu0 = Cu+2(NO3)2 + N+4O2 + H2O8


Взаимодействие азотной кислоты с неметалламиАзотная кислота как сильный окислитель Окисляет неметаллы до соответствующих кислот. Концентрированная (более 60%) азотная кислота восстанавливается до NO2 , а если концентрация кислоты (15 – 20%), то до NO.Расставьте в схемах коэффициенты методом электронного баланса.

Взаимодействие азотной кислоты с углем

Взаимодействие азотной кислоты с белым фосфором

Применение азотной кислотыПроизводство азотных и комплексных удобрений.Производство взрывчатых веществПроизводство красителейПроизводство лекарствПроизводство пленок,нитролаков, нитроэмалейПроизводство искусственных волоконКак компонент нитрующейсмеси, для траленияметаллов в металлургии

Соли азотной кислотыКак называются соли азотной кислоты? Нитраты K, Na, NH4+ называют селитрами Составьте формулы перечисленных солей.Нитраты – белые кристаллические вещества. Сильные электролиты, в растворах полностью диссоциируют на ионы. Вступают в реакции обмена.Каким способом можно определить нитрат-ион в растворе?К соли (содержащей нитрат-ион) добавляют серную кислоту и медь. Смесь слегка подогревают. Выделение бурого газа (NO2) указывает на наличие нитрат-иона.

Нитрат калия (калиевая селитра)Бесцветные кристаллы Значительно менее гигроскопична по сравнению снатриевой, поэтому широко применя-ется в пиротехнике как окислитель.При нагревании выше 334,5ºС плавится, выше этой температуры разлагается с выделением кислорода. Нитрат натрияПрименяется как удобрение; в стекольной, металлообрабатываю-щей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей.

Нитрат аммонияКристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210°С происходит полное разложение.

При нагревании нитраты разлагаются тем полнее, чем правее в электрохимическом ряду напряжений стоит металл, образующий соль.Составьте уравнения реакций разложения нитрата натрия, нитрата свинца, нитрата серебра.

1. Степень окисления азота в азотной кислоте равна: А) +5; Б) +4; В) -3.2. При взаимодействии с какими веществами азотная кислота проявляет особые свойства, отличающие её от других кислот: А) основными оксидами; Б) металлами; В) основаниями.3. В окислительно-восстановительной реакции азотная кислота может участвовать в качестве: А) окислителя; Б) восстановителя; В) окислителя и восстановителя.4. Какое из данных соединений азота называют чилийской селитрой: А) нитрат калия; Б) нитрат кальция; В) нитрат натрия;5. Запишите уравнение взаимодействия меди с концентрированной азотной кислотой . Коэффициент перед формулой кислоты равен: А) 2; Б) 4; В) 1. 6. Какое из перечисленных веществ не реагирует с разбавленной азотной кислотой: А) медь; Б) гидроксид натрия; В) бромид натрия.7. Азотную кислоту получают в три стадии, окисляя атом азота по следующей схеме: А) N–3 →N+2 →N+4 → N+5 Б) N–3 →N0 →N+4 → N+5 В) N0 →N+2 →N+4 → N+5