Презентация на тему: Азотная кислота

Это какое «особенное» вещество? Это кислородсодержащее соединение элемента с порядковым номером 7. Это «дымящая» с резким раздражающим запахом жидкость. Это вещество – враг металлов. Это «царица» всех … Угадай – те, тему урока! ? №7 *

«Азотная кислота» * Тема урока:
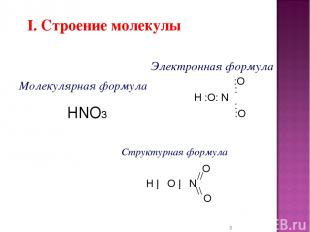
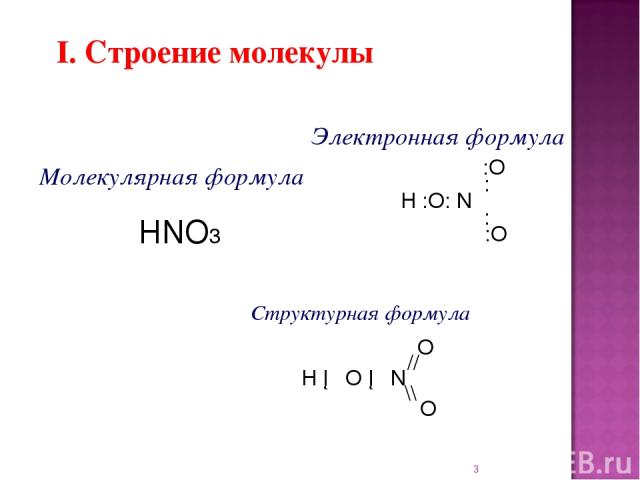
* I. Строение молекулы Электронная формула :O : H :O: N : :O Структурная формула O // H ─ O ─ N \\ O Молекулярная формула HNO3
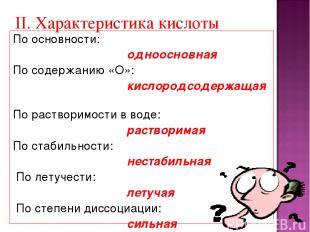
По основности: одноосновная По содержанию «О»: кислородсодержащая По растворимости в воде: растворимая По стабильности: нестабильная По летучести: летучая По степени диссоциации: сильная II. Характеристика кислоты

Ж., з., ρ = 1,51 г/см3, tпл = - 420С, tкип = 860С НNO3 (конц., дымящая) ω = 1, желтая НNO3 (разб., недымящая) ω = 0,6 бесцветная III. Физические свойства Правила обращения с концентрированной азотной кислотой «Дымит», так как пары ее образуют с влагой воздуха мелкие капельки тумана HNO3 ----------> Работать в резиновых перчатках! Берегись ожога! При попадании кислоты на кожу место поражения быстро промыть большим количеством воды! свет ! 4NO2 ↑+ O2 ↑ + 2H2O *

«Азотная кислота по характеру среди своих подруг - самая сильная и уверенная в себе . Внешне это не проявляется» III. Химические свойства II. Специфические свойства I. Общие с другими кислотами *

I. Общие с другими кислотами НNO3 + лакмус фиолетовый = * НNO3 + метиловый оранжевый = НNO3 H+ + NO3-

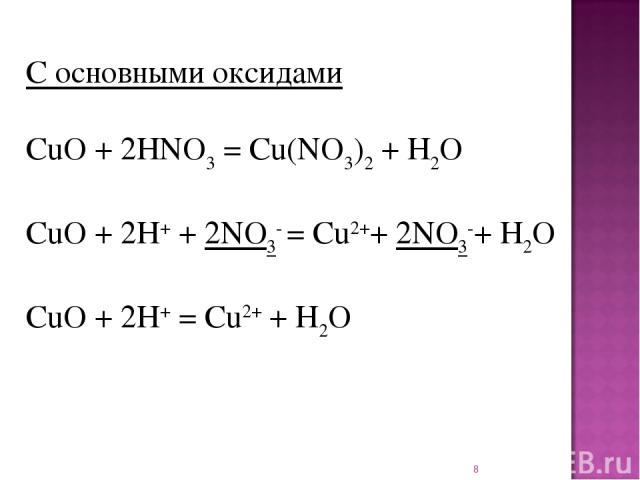
* С основными оксидами CuO + 2HNO3 = Cu(NO3)2 + H2O CuO + 2H+ + 2NO3- = Cu2++ 2NO3-+ H2O CuO + 2H+ = Cu2+ + H2O

* С основаниями (нерастворимыми): Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O Cu(OH)2 + 2H++ 2NO 3- = Cu2+ + 2NO3- + 2H2O Cu(OH)2 + 2H+ = Cu2+ + 2H2O

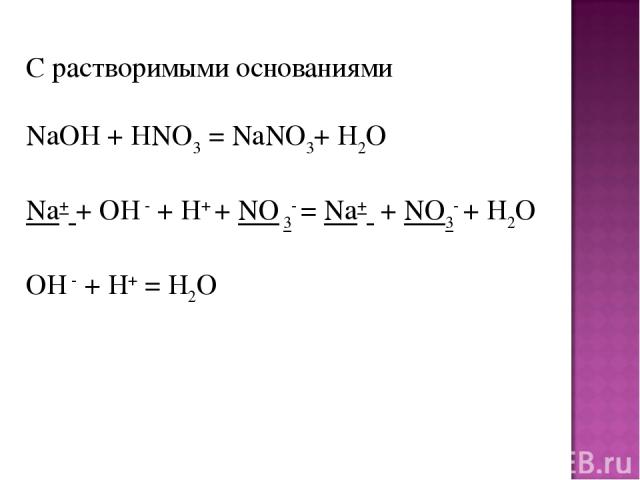
С растворимыми основаниями NaOH + HNO3 = NaNO3+ H2O Na+ + OH - + H+ + NO 3- = Na+ + NO3- + H2O OH - + H+ = H2O

* C солями (более слабых кислот): Na2CO3 + 2HNO3 = 2NaNO3 + CO2+ H2O 2Na+ + CO32 - + 2H+ + 2NO3- = 2Na ++ 2NO3-+ CO2 ↑ + H2O CO32- + 2H+ = CO2 ↑ + H2O
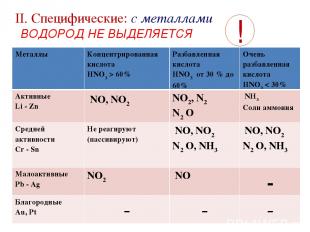
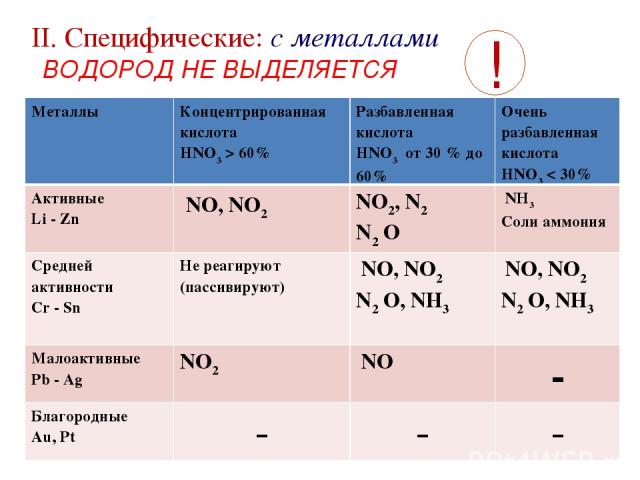
II. Cпецифические: с металлами ВОДОРОД НЕ ВЫДЕЛЯЕТСЯ ! Металлы Концентрированная кислота HNO3 > 60% Разбавленная кислота HNO3 от 30 % до 60% Очень разбавленная кислота HNO3 < 30% Активные Li - Zn NO, NO2 NO2, N2 N2 O NН3 Соли аммония Средней активности Cr - Sn Не реагируют (пассивируют) NO, NO2 N2 O, NН3 NO, NO2 N2 O, NН3 Малоактивные Pb - Ag NO2 NO - Благородные Au, Pt - - -

Схема уравнения Ме +HNO3 = соль + вода + оксиды азота (нитрат Ме) (аммиак, соли аммония) Cu + HNO3 (конц) = Cu(NO3)2 + NO2 ↑ + 2H2O Cu + 4HNO3 (конц) = Cu(NO3)2 + 2 NO2 ↑ + 2H2O Zn + HNO3(разб) = Zn(NO3)2 + NH4NO3 + H2O 4Zn + 10HNO3(разб) = 4Zn(NO3)2 + NH4NO3 + 3H2O
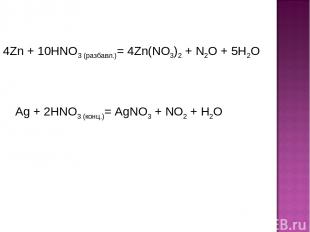
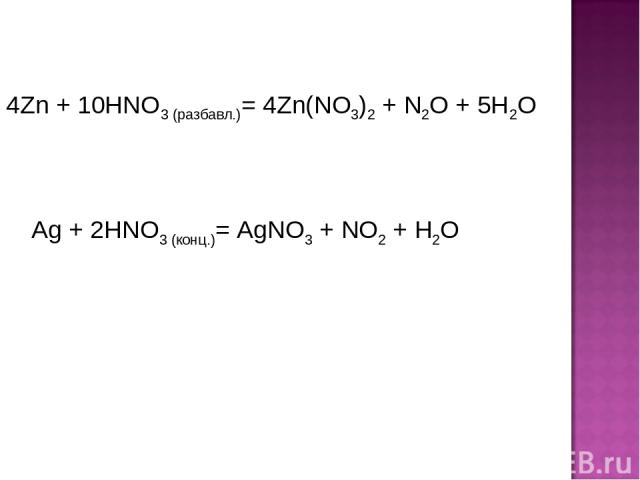
4Zn + 10HNO3 (разбавл.)= 4Zn(NO3)2 + N2O + 5H2O Ag + 2HNO3 (конц.)= AgNO3 + NO2 + H2O
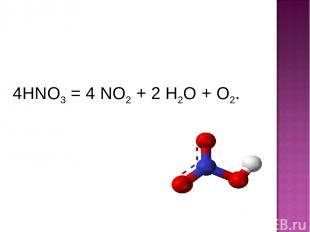
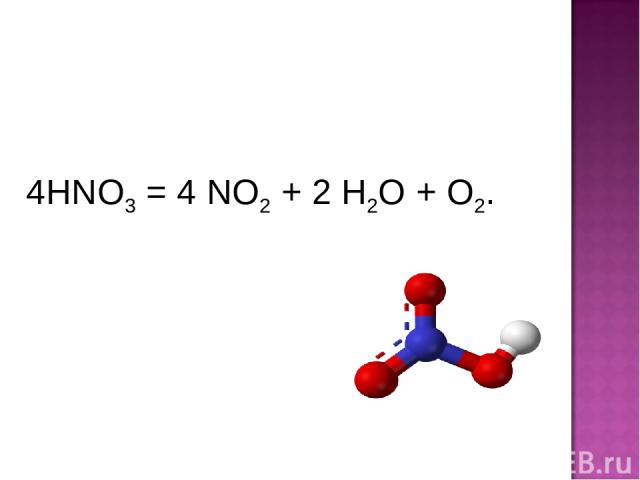
4HNO3 = 4 NO2 + 2 H2O + O2.

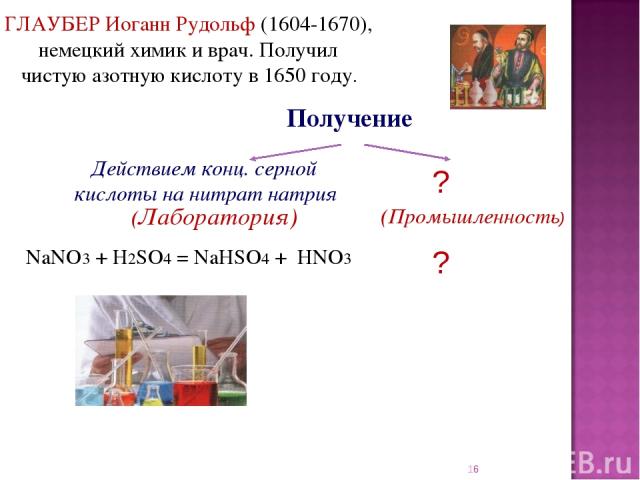
* Получение ГЛАУБЕР Иоганн Рудольф (1604-1670), немецкий химик и врач. Получил чистую азотную кислоту в 1650 году. Завод азотной кислоты NaNO3 + H2SO4 = NaHSO4 + HNO3 Действием конц. серной кислоты на нитрат натрия (Лаборатория)
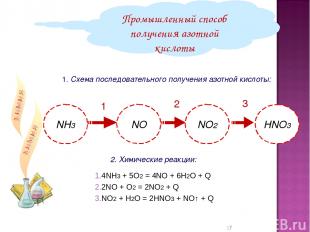
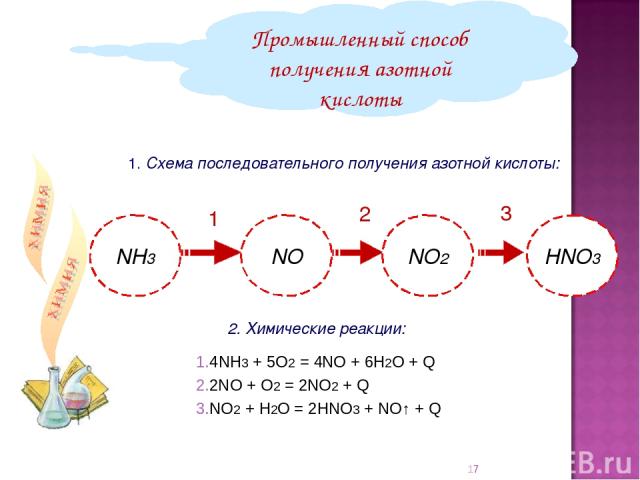
1. Схема последовательного получения азотной кислоты: Промышленный способ получения азотной кислоты 2. Химические реакции: 1 2 3 4NH3 + 5О2 = 4NO + 6Н2О + Q 2NO + O2 = 2NO2 + Q NO2 + H2O = 2HNO3 + NO↑ + Q *

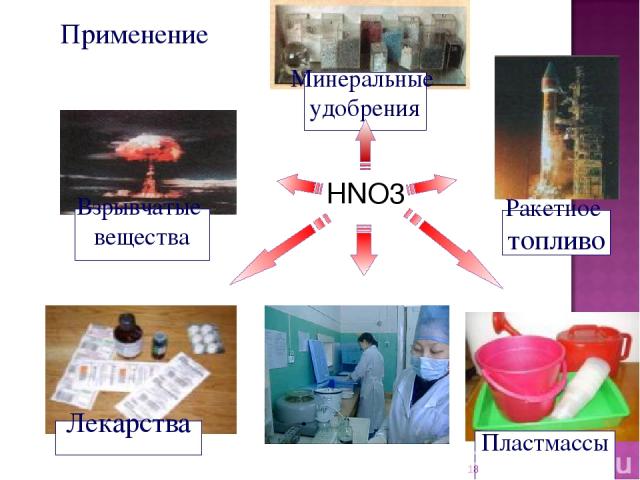
Применение HNO3 *

Согласны ли вы со следующими утверждениями: ? 1. Азотная кислота является сильным окислителем. 2. Азотная кислота взаимодействует только с растворимыми основаниями. 3. Азотная кислота разлагается на свету. 4. Соли азотной кислоты называются нитритами. 5. Азотная кислота взаимодействует только с металлами стоящими в ряду активности до водорода. 6. Азотная кислота пассивирует алюминий. 7. Азотную кислоту в промышленности получают из аммиака. 8. При взаимодействии азотной кислоты с металлами водород не выделяется.

* ПРОВЕРЬ СЕБЯ ! 1. Да 2. Нет 3. Да 4. Нет 5. Нет 6. Да 7. Да 8. Да

Домашнее задание §21 Выполнить задание № 5, №7 стр. 63 Поиск информации о солях азотной кислоты в сети Интернет *