Презентация на тему: Азотная кислота

Азотная кислота

Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде «Ямщик мудрости», а с ХV века это вещество добывалось для производственных целей. Благодаря этому веществу, русский учёный В.Ф. Петрушевский в 1866 году впервые получил динамит. Это вещество – прародитель большинства взрывчатых веществ (например, тротила, или тола). Это вещество является компонентом ракетного топлива, его использовали для двигателя первого в мире советского реактивного самолёта БИ – 1. Это вещество в смеси с соляной кислотой растворяет платину и золото, признанное «царём» металлов.
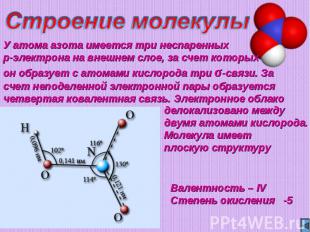
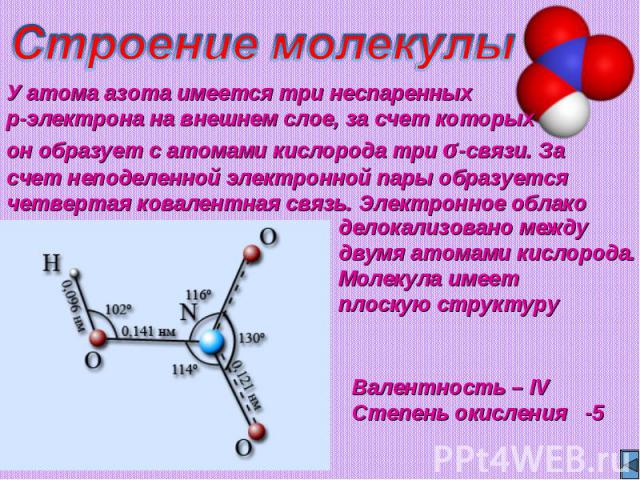
Строение молекулыУ атома азота имеется три неспаренных p-электрона на внешнем слое, за счет которых он образует с атомами кислорода три σ-связи. За счет неподеленной электронной пары образуется четвертая ковалентная связь. Электронное облако делокализовано между двумя атомами кислорода. Молекула имеет плоскую структуруВалентность – IVСтепень окисления -5

Физические свойства Бесцветная жидкость, дымящая на воздухе. Едкий запах. Желтый цвет концентрированной кислоты (разложение с образованием NO2) 4HNO3 = 4NO2↑ + 2H2O + O2↑ Плотность 1,52 г/см3. Температура кипения – 860С. Температура затвердевания – -41,60С. Гигроскопична. С водой смешивается в любых соотношениях.
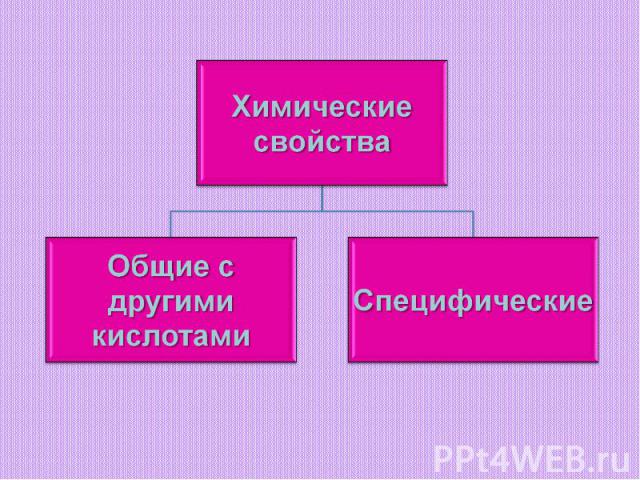
ХимическиесвойстваОбщие с другимикислотамиСпецифические

Химические свойстваРазбавленная азотная кислота проявляет свойства, общие для всех кислот: Реакция с основаниями: NaOH + HNO3 = NaNO3 + H2O Cu(OH)2↓ + 2HNO3 = Cu(NO3)2 + 2H2O Реакция с основными оксидами: CaO + 2HNO3 = Ca(NO3)2 + H2O Реакция с солями: Na2CO3 + 2HNO3 = 2NaNO3 + H2O + CO2↑

Специфические свойства – взаимодействие с металламиЗАПОМНИ!При взаимодействии азотной кислоты любой концентрации с металлами водород никогда не выделяется. Продукты зависят от металла и концентрации кислоты.
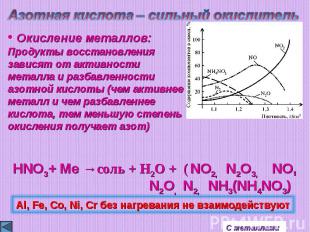
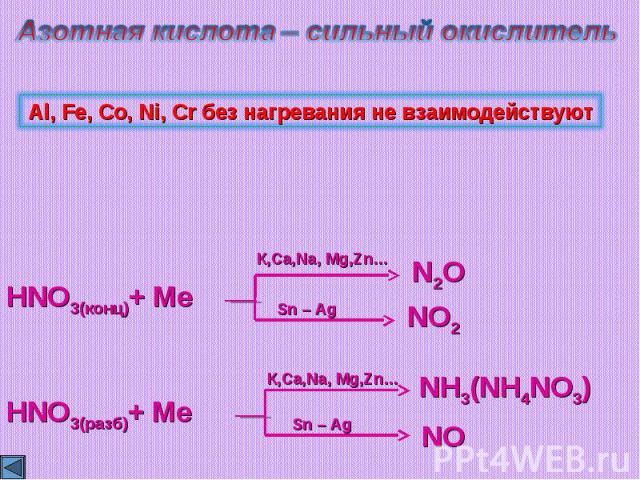
Азотная кислота – сильный окислитель Окисление металлов:Продукты восстановлениязависят от активности металла и разбавленностиазотной кислоты (чем активнее металл и чем разбавленнее кислота, тем меньшую степень окисления получает азот)Al, Fe, Co, Ni, Cr без нагревания не взаимодействуют
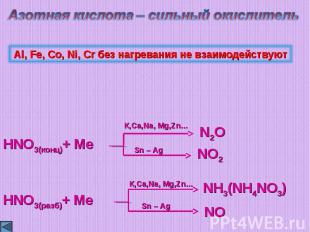
Азотная кислота – сильный окислительAl, Fe, Co, Ni, Cr без нагревания не взаимодействуют
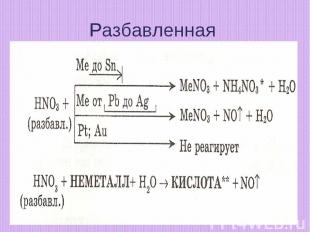
Разбавленная

Концентрированная
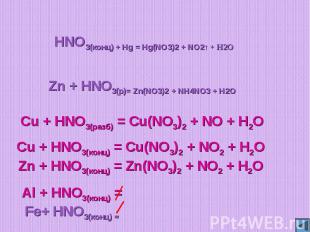
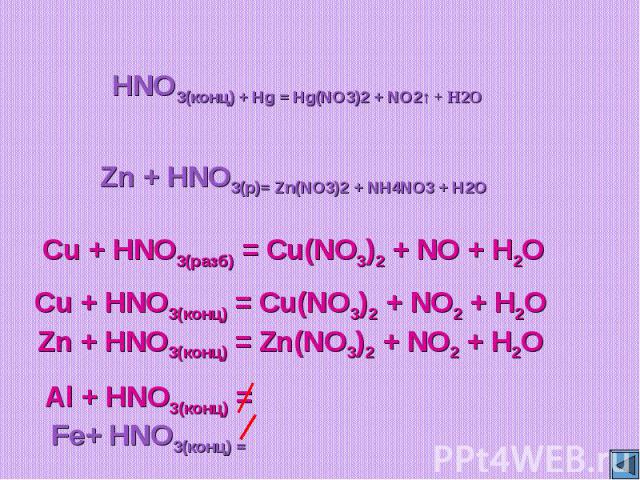
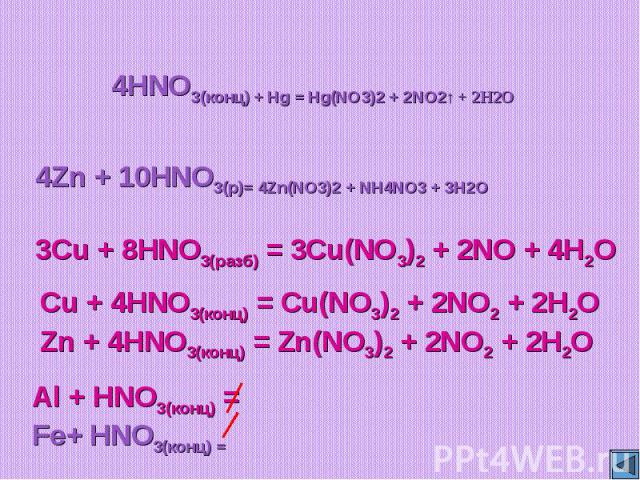
HNO3(конц) + Hg = Hg(NO3)2 + NO2↑ + H2OZn + HNO3(р)= Zn(NO3)2 + NH4NO3 + H2OCu + HNO3(разб) = Cu(NO3)2 + NO + H2OCu + HNO3(конц) = Cu(NO3)2 + NO2 + H2OZn + HNO3(конц) = Zn(NO3)2 + NO2 + H2O
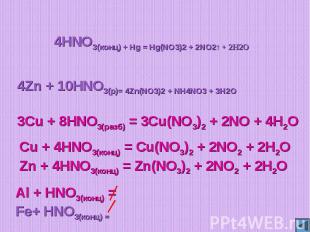
4HNO3(конц) + Hg = Hg(NO3)2 + 2NO2↑ + 2H2O4Zn + 10HNO3(р)= 4Zn(NO3)2 + NH4NO3 + 3H2O3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO + 4H2OCu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 + 2H2OZn + 4HNO3(конц) = Zn(NO3)2 + 2NO2 + 2H2O

Взаимодействие с неметалламиПри взаимодействии с неметаллами образуется кислота, в которой у неметалла высшая степень окисления, и продукт по схеме:NO неMe + HNO3 NO2P+5HNO3(к.)H3PO4+5NO2+H2O3P+5HNO3(р)+2H2O3H3PO4+5NO
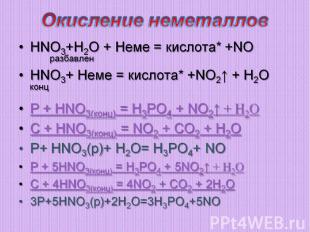
Окисление неметаллов НNO3+H2O + Неме = кислота* +NOразбавлен НNO3+ Неме = кислота* +NO2↑ + H2O концР + HNO3(конц) = H3PO4 + NO2↑ + H2OC + HNO3(конц) = NO2 + CO2 + H2OP+ HNO3(р)+ H2O= H3PO4+ NOР + 5HNO3(конц) = H3PO4 + 5NO2↑ + H2OC + 4HNO3(конц) = 4NO2 + CO2 + 2H2O3P+5HNO3(р)+2H2O=3H3PO4+5NO

Органические веществаокисляются и воспламеняютсяв азотной кислоте.Белки при взаимодействии с конц. азотной кислотой разрушаются и приобретают жёлтую окраску .Под действием азотной кислоты воспламеняются бумага, масло, древесина, уголь.

Смесь концентрированных азотной и соляной кислот (соотношение по объему 1 :3) называется царской водкой; она растворяет даже благородные металлы. Смесь HNO3 концентрации 100% и H2SO4 концентрации 96% при их соотношении по объему 9:1 называют меланжем.

Получение азотной кислотыПромышленный способОкисления аммиaка в NO в присутствии платино-родиевого катализатора: 4NH3 + 5O2 = 4NO + 6H2O2. Окисления NO в NO2 на холоду под давлением (10 ат):2NO + O2 = 2NO23. Поглощения NO2 водой в присутствии кислорода:4NO2 + 2H2O + O2= 4HNO3 Массовая доля HNO3 составляет около 60%

Получение азотной кислотыВ лаборатории – взаимодействием калиевой или натриевой селитры с концентрированной серной кислотой при нагревании:KNO3 + H2SO4 = HNO3 + KHSO4

Нитраты – соли азотнойкислоты (cелитры)Получаются при взаимодействии азотной кислоты с металлами, оксидами металлов, основаниями, аммиаком и некоторыми солями.Физические свойства. Это твердые кристаллические вещества, хорошо растворимые в воде.

Нитраты – соли азотнойкислоты (cелитры)Химические свойства. Сильные электролиты,проявляют все свойства солей. Cu(NO3)2 + 2KOH = Cu(OH)2↓ + 2KNO3 AgNO3 + NaCl = AgCl↓ + NaNO3 Pb(NO3)2 + Zn = Pb + Zn(NO3)2 Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3

Разложение нитратовпри нагревании2KNO3 = 2KNO2 + O2↑2Cu(NO3)2 = 2CuO + 4NO2↑ + O2↑2AgNO3 = 2Ag + 2NO2↑ + O2↑Разложение нитрата аммония: NH4NO3 = N2O + 2H2O

Качественные реакции наазотную кислоту и ее солиNaNO3 + H2SO4 = NaHSO4 + HNO34HNO3 + Cu = Cu(NO3)2 + 2NO2↑ +2H2OТвердые нитраты. Щепотку соли бросают в огонь горелки. Происходит яркая вспышка.
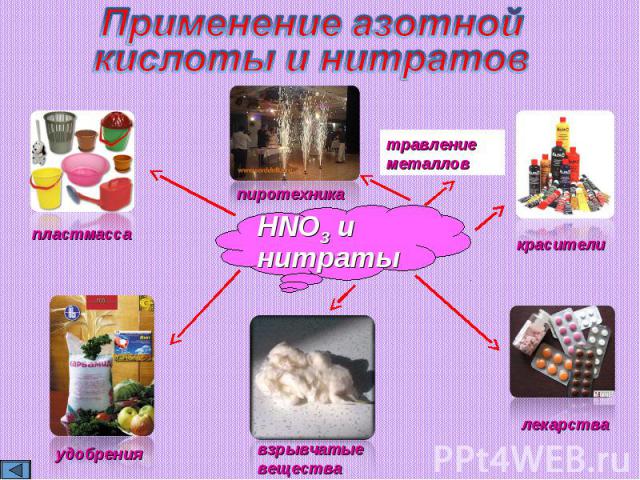
Применение азотнойкислоты и нитратов
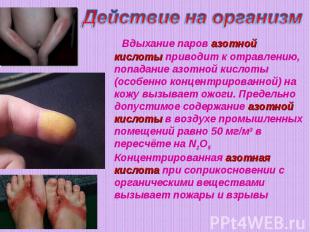
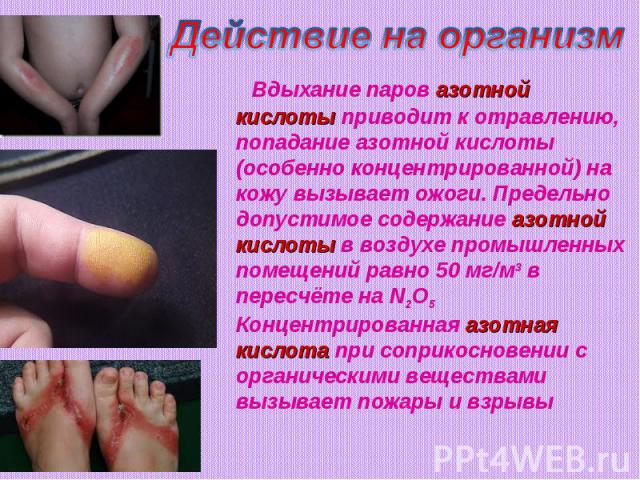
Действие на организм Вдыхание паров азотной кислоты приводит к отравлению, попадание азотной кислоты(особенно концентрированной) на кожу вызывает ожоги. Предельно допустимое содержание азотной кислоты в воздухе промышленных помещений равно 50 мг/м3 в пересчёте на N2O5 Концентрированная азотная кислота при соприкосновении с органическими веществами вызывает пожары и взрывы

Исследования (задания по группам): (Повторение ПТБ!). 1 группа: провести реакцию раствора азотной кислоты и оксида меди (II), записать уравнение реакции, определить ее тип 2 группа: получить нерастворимое основание Cu(OH)2; провести реакцию раствора азотной кислоты и гидроксида меди (II); записать уравнение реакции, определить ее тип 3 группа: провести реакцию растворов азотной кислоты и карбоната натрия, записать уравнение реакции, определить ее типДля всех: провести реакцию растворов азотной кислоты и Гидроксида калияв присутствии фенолфталеина, записать уравнение реакции, определить ее тип

Группа №1 CuO + 2 HNO3 = Cu(NO3)2 + H2O - реакция ионного обмена, необратимая CuO + 2H+ + 2 NO3- = Cu2+ + 2 NO3- + H2O CuO + 2H+ = Cu2+ + H2OГруппа №2 CuCl2 + 2 NaOH = Cu(OH)2 + 2 NaCl (получение нерастворимого основания) Cu(OH)2 + 2 HNO3 = Cu(NO3)2 + 2 H2O - реакция ионного обмена, необратимая Cu(OH)2 + 2H+ + 2 NO3- = Cu2+ + 2 NO3- + 2 H2O Cu(OH)2 + 2H+ = Cu2+ + 2 H2O Группа №3 2 HNO3 + Na2CO3 = 2 NaNO3 + H2O + CO2 - реакция ионного обмена, необратимая 2 H+ + 2NO3- + 2 Na+ + CO3 2- = 2 Na+ +NO3- + H2O + CO2 2 H+ + CO3 2- = H2O + CO2 Признак реакции – характерное «вскипание».

Взаимодействие с металлами P.S концентрированная HNO3 >60% разбавленная HNO3 = 30-60% очень разбавленная HNO3 < 30%

Проверь себя:Степень окисления азота в HNO3 а)-3 б)0 в)+5 г)+4При хранении на свету HNO3 а) краснеет б) желтеет в) остается бесцветнойПри взаимодействии с металлами азотная кислота является: а)окислителем, б)восстановителем, в)и тем, и другим.Азотная кислота в растворе не реагирует с веществом, формула которого:а) CO2 ; б) NaOH; в) Al(OH)3 ; г) NH3 .Царская водка- это а)концентрированный спирт б)3 объема HCl и 1 объем HNO3 в) концентрированная азотная кислота

ключ1 - в2 - б3 - а4 - а5 - б

вывод: 1. Азотной кислоте характерны общие свойства кислот: реакция на индикатор, взаимодействие с оксидами металлов, гидроксидами, солями более слабых кислот обусловленные наличием в молекулах иона Н+;2. Сильные окислительные свойства азотной кислоты обусловлены строением ее молекулы; При ее взаимодействии с металлами никогда не образуется водород, а образуются нитраты, оксиды азота или другие его соединения (азот, нитрат аммония) и вода в зависимости от концентрации кислоты и активности металла; 3. Сильные окислительные способности HNO3 широко применяются для получения различных важных продуктов народного хозяйства (удобрения, лекарства, пластики и т.д.)

Благодарю за внимание