Презентация на тему: Кислородные соединения азота. Азотная кислота

Кислородные соединения азота. Азотная кислота МБОУ СОШ №30г.Ростов-на-Дону

Проверка знаний

1.Определите, о каком веществе идёт речьI вариант Бесцветный газ, плохо растворим в воде, легко соединяется с кислородом воздуха, образуя бурый газ. Бесцветный газ с характерным резким запахом, хорошо растворим в воде, легче воздуха.
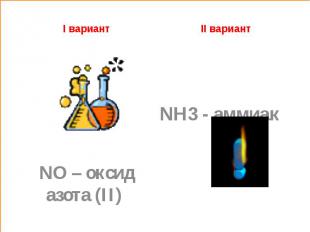
I вариант II вариант NH3 - аммиак NO – оксид азота (II)

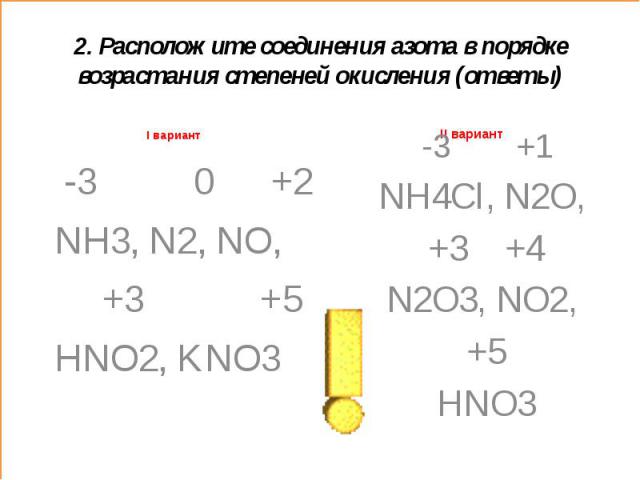
2. Расположите соединения азота в порядке возрастания степеней окисленияI вариант N2, NH3, KNO3, NO, HNO2 NO2, N2O, HNO3, NH4Cl, N2O3
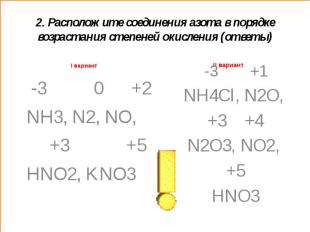
2. Расположите соединения азота в порядке возрастания степеней окисления (ответы)I вариант -3 0 +2 NH3, N2, NO, +3 +5HNO2, KNO3 -3 +1NH4Cl, N2O, +3 +4N2O3, NO2, +5HNO3
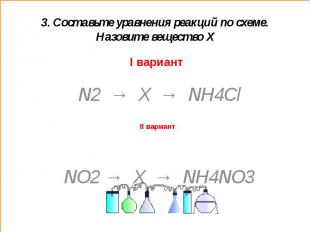
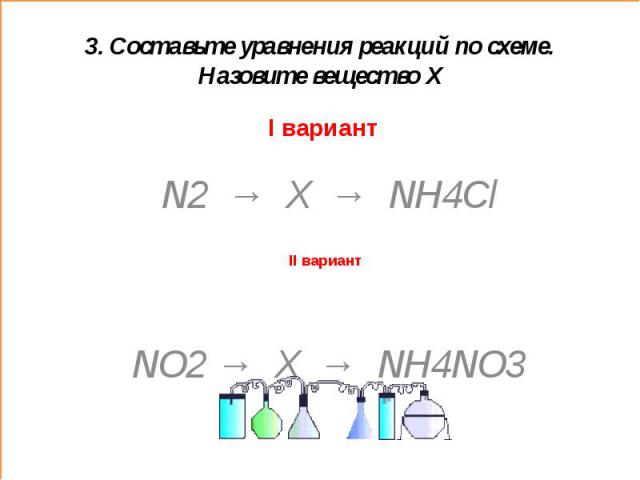
3. Составьте уравнения реакций по схеме. Назовите вещество ХI вариант N2 → X → NH4Cl NO2 → X → NH4NO3

3. Составьте уравнения реакций по схеме. Назовите вещество Х (ответы)I вариант X – NH3 (аммиак)1. N2 + 3H2=2NH32. NH3 + HCl = NH4Cl X – HNO3 (азотная кислота)1.4NO2+2H2O+O2=4HNO32. HNO3 + NH3=NH4NO3

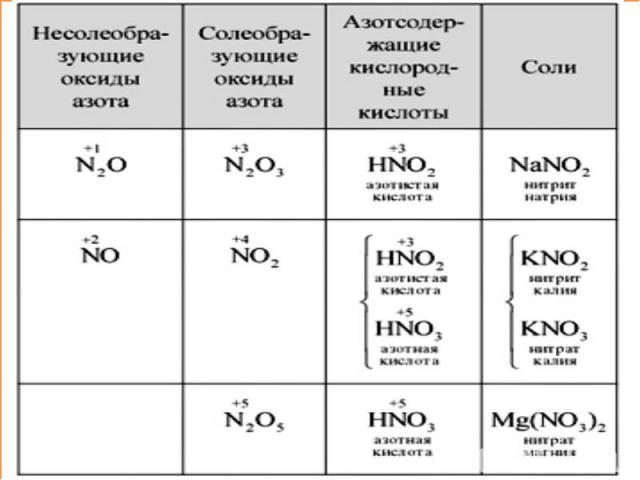
Кислородные соединения азота. Азотная кислота План изучения:I. Оксиды азота. Физические свойства азотной кислоты;II. Характеристика кислоты;III. Химические свойства ;IV. Применение азотной кислоты.
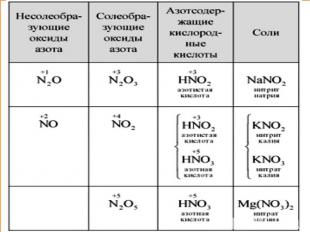

I. Физические свойстваазотной кислоты Агрегатное состояние – жидкость; Цвет – отсутствует;Запах – едкий, кислотный; Растворимость в воде – хорошая;«Дымит» на воздухе;«Особые приметы»: при хранении на свету разлагается, приобретая желтоватый оттенок: 4HNO3=4NO2↑ + O2↑ + 2H2O

II. Характеристика HNO3 По основности: одноосновная2. По содержанию «О»: кислородсодержащая 3. По растворимости в воде: растворимая 4. По стабильности: нестабильная5. По летучести: летучая6. По степени диссоциации: сильная

III. Химические свойства HNO3 Свойства HNO3 как электролитаДиссоциация: HNO3 = H+ + NO3 – ВзаимодействуетА) с оксидами металлов: CuO + 2HNO3 = Cu(NO3)2 + H2O CuO + 2H+ = Cu2+ + H2OБ) с основаниями: Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O Cu(OH)2 + 2H+ = Cu2+ + 2H2OВ) с солями: Na2CO3 + 2HNO3 = 2NaNO3 + CO2↑ + H2O CO32- + 2H+ = CO2 + H2O

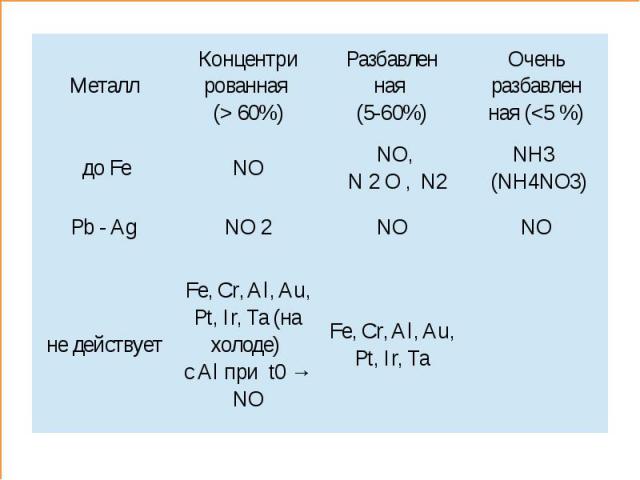
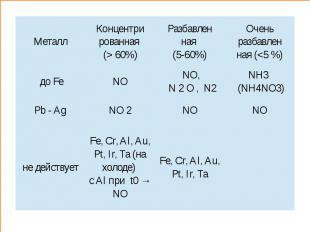
III. Химические свойства HNO3 2. Окислительные свойства Взаимодействует с металлами:K Ca Na Mg Al Zn Cr Fe Pb H2 Cu Hg Ag Au Ме + HNO3 → Me(NO3)n + H2O + NxOy Cu + 4HNO3(конц) = Cu(NO3)2 + 2H2O + 2NO2↑3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 4H2O + 2NO↑ Me + HNO3 = Me(NO3)2 + H2↑

2. Окислительные свойства Взаимодействует с неметаллами: (S, P, C) C + 4HNO3 → CO2 + 2H2O + 4NO2 Взаимодействует с органическими веществами (скипидар)
IV. Применение азотной кислоты HNO3

I. Назовите вещества, с которыми может реагировать азотная кислота как электролит: SO2 H2 ZnO Ca(OH)2 HCl Na2SiO3 AgII. Азотную кислоту применяют для определения примесей в золотых изделиях. Объясните, чем в ряде случаев обуславливается появление бурого газа и голубого раствора при обработке золота кислотой?

Домашнее задание§ 27, упр. 5,6