Презентация на тему: Азот

Тема урока: Общая характеристика подгруппы азота. Азот. Физические и химические свойства. Общая характеристика подгруппы азота Строение электронной оболочки атома Строение молекулы азота История открытия азота Физические свойства азота Азот – окислитель и восстановитель. Способы получения азота. Итоговое тестирование 900igr.net
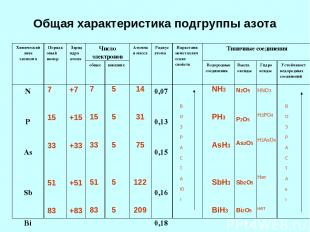
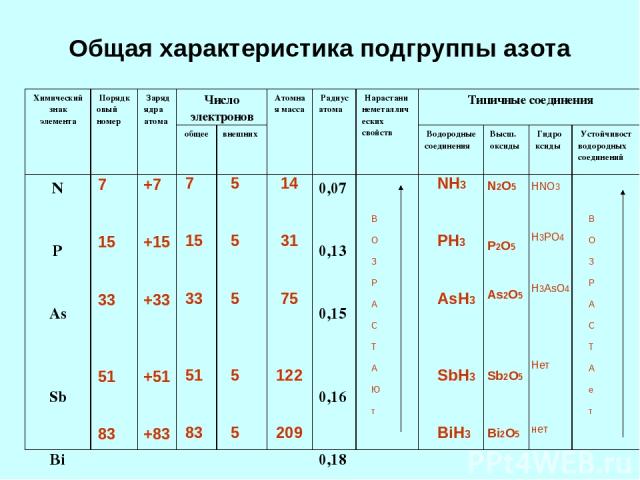
Общая характеристика подгруппы азота 7 15 33 51 83 7 15 33 51 83 +7 +15 +33 +51 +83 5 5 5 5 5 14 31 75 122 209 В О З Р А С Т А Ю т В О З Р А С Т А е т NH3 PH3 AsH3 SbH3 BiH3 N2O5 P2O5 As2O5 Sb2O5 Bi2O5 HNO3 H3PO4 H3AsO4 Нет нет Химический знак элемента Порядковый номер Заряд ядра атома Число электронов Атомная масса Радиус атома Нарастани неметаллических свойств Типичные соединения общее внешних Водородные соединения Высш. оксиды Гидроксиды Устойчивостводородных соединений N P As Sb Bi 0,07 0,13 0,15 0,16 0,18
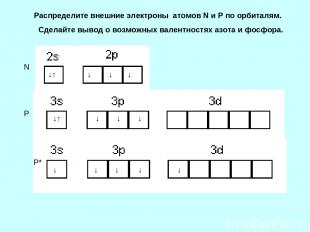
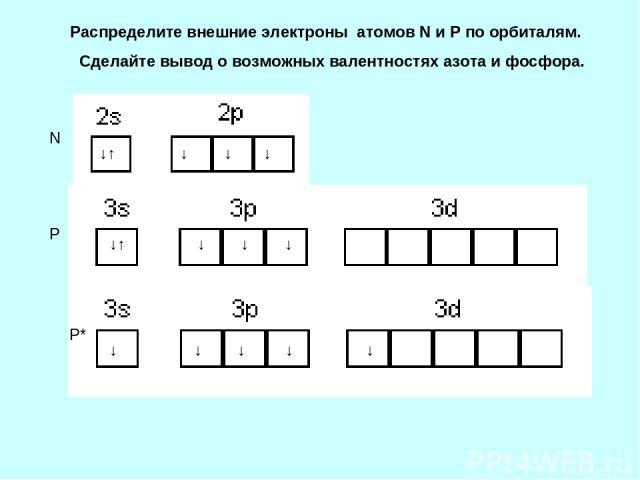
Распределите внешние электроны атомов N и P по орбиталям. Сделайте вывод о возможных валентностях азота и фосфора. ↓↑ ↓ ↓ ↓ ↓↑ ↓ ↓ ↓ N P P* ↓ ↓ ↓ ↓ ↓

История открытия азота. Открыт в 1772 шотландским ученым Д. Резерфордом в составе продуктов сжигания угля, серы и фосфора. Газ, непригодный для дыхания и горения («удушливый воздух»). Французский химик А. Л. Лавуазье пришел к выводу, что «удушливый» газ входит в состав атмосферного воздуха, и предложил для него название «azote» (от греч. azoos — безжизненный). В 1784 английский физик и химик Г. Кавендиш установил присутствие азота в селитре (отсюда латинское название азота, предложенное в 1790 французским химиком Ж. Шанталем). (лат. Nitrogenium — рождающий селитры). А. Л. Лавуазье

Физические свойства АЗОТА Азот в свободном состоянии - газ без цвета и запаха, мало растворимый в воде. Он несколько легче воздуха, при - 196 C конденсируется, а при - 210 C замерзает. Молекула азота двухатомна.
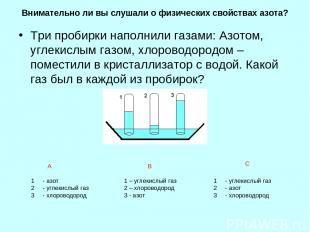
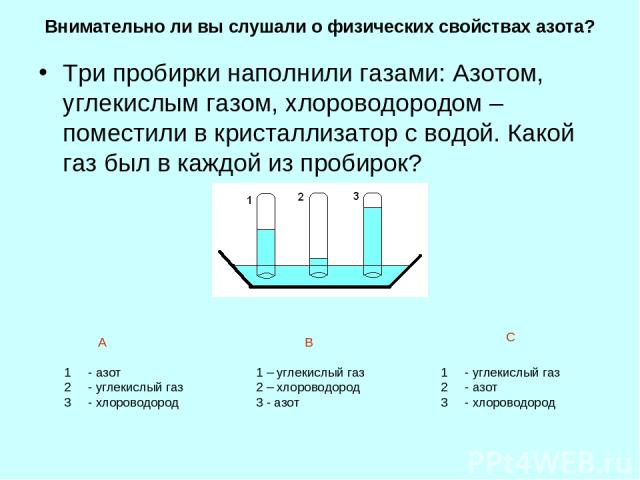
Внимательно ли вы слушали о физических свойствах азота? Три пробирки наполнили газами: Азотом, углекислым газом, хлороводородом – поместили в кристаллизатор с водой. Какой газ был в каждой из пробирок? - азот - углекислый газ - хлороводород 1 – углекислый газ 2 – хлороводород 3 - азот - углекислый газ - азот - хлороводород А В С
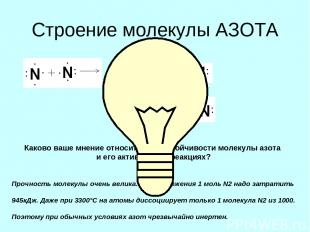
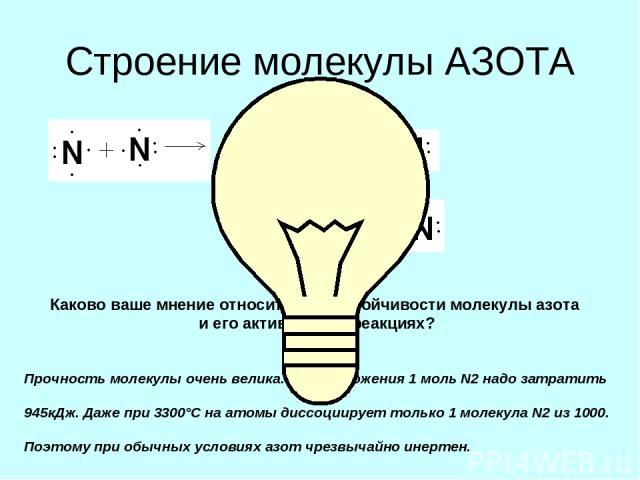
Строение молекулы АЗОТА Каково ваше мнение относительно устойчивости молекулы азота и его активности в реакциях? Прочность молекулы очень велика. Для разложения 1 моль N2 надо затратить 945кДж. Даже при 3300°С на атомы диссоциирует только 1 молекула N2 из 1000. Поэтому при обычных условиях азот чрезвычайно инертен.

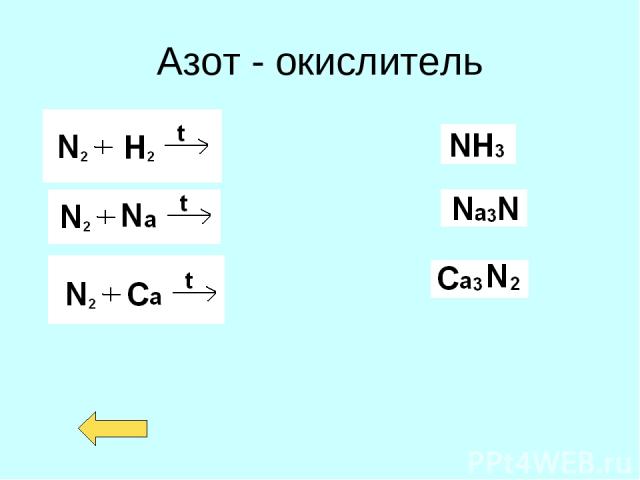
Химические свойства азота Ряд электроотрицательности элементов Rb K Na Li Ca Mg Al Si B As P Te Se C S I Br Cl N O F Азот – восстановитель Азот – окислитель

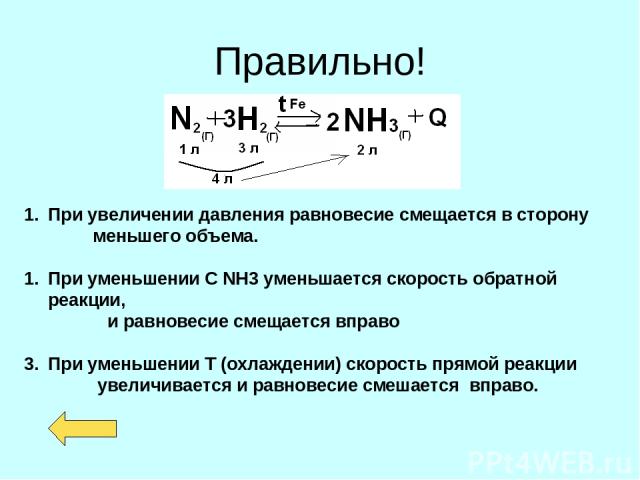
Нитриды щелочных и щелочно-земельных металлов имеют ионную кристаллическую решетку и являются типичными солями. Какой набор внешних факторов позволит наиболее полно сместить равновесие реакции в сторону образования продуктов? Р уменьшить Т уменьшить СNH3 увеличить Р увеличить Т уменьшить С NH3 уменьшить Р увеличить Т увеличить С Н2 уменьшить А С В

Способы получения азота В лаборатории азот получают разложением нитрита аммония при нагревании: NH4NO2 = N2 + 2H2O Или взаимодействием смеси водных раст воров нитрита натрия и хлорида аммония: NaNO2 + NH4Cl = N2 + NaCl + 2H2O В промышленности азот получают из воздуха, используя различие в температурах кипения азота и кислорода.

Итоговое тестирование 1. Кислотные свойства в ряду: N2O3 – P2O3 – As2O3 –Sb2O3 – Bi2O3 увеличиваются уменьшаются Остаются неизменными 2. Азот имеет положительную степень окисления в соединениях с элементами: кислород магний водород 3. Максимальная массовая доля азота содержится в соединении KNO3 N2O3 NH4NO3 4. Азот можно получить термическим разложением соли NaNO3 NH4NO2 Cu(NO3)2
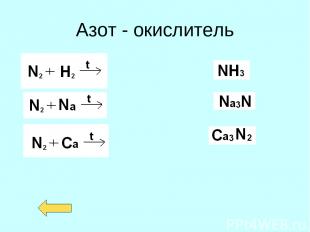
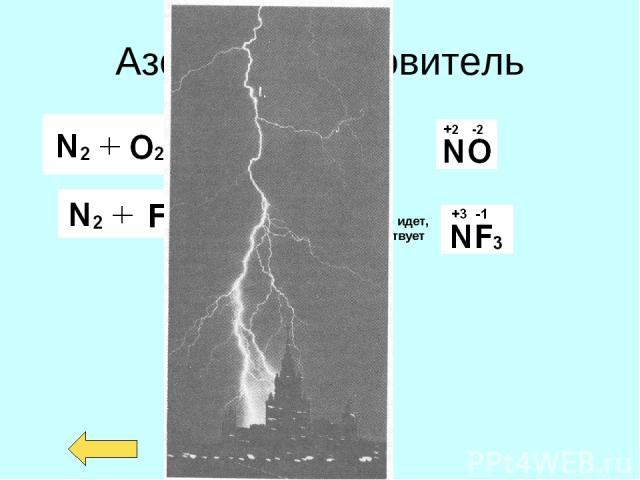
Азот - окислитель
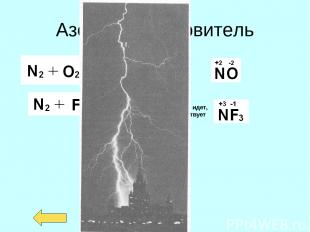
Азот - восстановитель Реакция на прямую не идет, но соединение существует

Вы попали пальцем в небо !

ВЫ МОЛОДЕЦ ! В 1 л воды растворяется: 18мл азота; 880мл углекислого газа; 500 л хлороводорода.

УВЫ !!! Вы слишком быстро забыли пройденный материал !

Правильно! При увеличении давления равновесие смещается в сторону меньшего объема. При уменьшении С NH3 уменьшается скорость обратной реакции, и равновесие смещается вправо При уменьшении Т (охлаждении) скорость прямой реакции увеличивается и равновесие смешается вправо.

Правильно!

Вы не правы!