Презентация на тему: Азот и его соединения

Азот и его соединения Презентация учителя химии МОУ СОШ №1 г. Алексеевки Белгородской области Е.П. Харченко для 9 класса

Строение и свойства атома азота Азот / Nitrogenium (N)Атомный номер -7Газ без цвета вкуса идостаточно инертный при нормальных условиях двухатомный газ без цвета, вкуса и запаха (формула N2).

Распростаненность азота Вне пределов Земли азот обнаружен в газовых туманностях, солнечной атмосфере, на Уране, Нептуне, межзвёздном пространстве и др. Азот — четвёртый по распространённости элемент Солнечной системы (после водорода, гелия и кислорода).Азот, в форме двухатомных молекул N2 составляет большую часть атмосферы, где его содержание составляет 75,6 % (по массе) или 78,084 % (по объёму), то есть около 3,87·1015 т.Содержится азота в земной коре в верхней части мантии, откуда он поступает в другие оболочки Земли с извержениями вулканов.Содержится азота в гидросфере в виде соединений.

Химические свойства азота Вследствие большой прочности молекулы азота многие его соединения термически малоустойчивы и довольно легко разлагаются при нагревании. Именно поэтому азот на Земле находится по большей части в свободном состоянии.Ввиду своей значительной инертности азот при обычных условиях реагирует только с литием: 6Li + N2 → 2Li3N,При нагревании он реагирует с некоторыми другими металлами и неметаллами, также образуя нитриды: 3Mg + N2 → Mg3N2, 2B + N2 →2BN,Наибольшее практическое значение имеет нитрид водорода (аммиак)

Биологическая роль азота Азот является элементом, необходимым для существования животных и растений, он входит в состав белков (16—18 % по массе), аминокислот, нуклеиновых кислот, нуклеопротеидов, хлорофилла, гемоглобина и др. В составе живых клеток по числу атомов азота около 2%, по массовой доле - около 2,5 % (четвертое место после водорода, углерода и кислорода). В связи с этим значительное количество связанного азота содержится в живых организмах, в веществе морей и океанов. В результате процессов гниения и разложения азотсодержащей органики, могут образоваться природные залежи полезных ископаемых, содержащие азот, например, «чилийская селитра» (нитрат натрия с примесями других соединений), норвежская, индийская селитры.

Круговорот азота в природе Фиксация атмосферного азота в природе происходит по двум основным направлениям — абиогенному и биогенному. Первый путь включает главным образом реакции азота с кислородом. Так как азот химически весьма инертен, для окисления требуются большие количества энергии (высокие температуры). Эти условия достигаются при разрядах молний, когда температура достигает 25000 °C и более. При этом происходит образование различных оксидов азота.

Круговорот азота в природе Однако основная часть молекулярного азота фиксируется биотическим путём. Долгое время считалось, что связывать молекулярный азот могут только клубеньковые бактерии бобовых растений, цианобактерии и др. Сейчас известно, что этой способностью обладают многие другие организмы в воде и почве, например, актиномицеты в клубнях ольхи и других деревьев (всего 160 видов). Все они превращают молекулярный азот в соединения аммония (NH4+). Этот процесс требует значительных затрат энергии. Таким образом, видна взаимная польза от симбиоза растений и азотфиксирующих бактерий — первые предоставляют вторым «место для проживания» и снабжают полученным в результате фотосинтеза «топливом» — глюкозой, вторые обеспечивают необходимый растениям азот в усваиваемой ими форме.

Азот в форме аммиака и соединений аммония быстро окисляется до нитратов и нитритов (этот процесс носит название нитрификации). Последние, не связанные тканями растений (и далее по пищевой цепи травоядными и хищниками), недолго остаются в почве. Большинство нитратов и нитритов хорошо растворимы, поэтому они смываются водой и в конце концов попадают в мировой океан. Азот, включённый в ткани растений и животных, после их гибели подвергается аммонификации (разложению содержащих азот сложных соединений с выделением аммиака и ионов аммония) и денитрификации то есть выделению атомарного азота, а также его оксидов. Эти процессы целиком происходят благодаря деятельности микроорганизмов в аэробных и анаэробных условиях.

Токсикология азота и его соединений Сам по себе атмосферный азот достаточно инертен, чтобы оказывать непосредственное влияние на организм человека и млекопитающих. Тем не менее, при повышенном давлении он вызывает наркоз, опьянение или удушье (при недостатке кислорода); при быстром снижении давления азот вызывает кессонную болезнь. Многие соединения азота очень активны и нередко токсичны.

Получение азота В лабораториях его можно получать 1. По реакции разложения нитрита аммония: NH4NO2 → N2↑ + 2H2OНагревание смеси дихромата калия и сульфата аммония (в соотношении 2:1 по массе). K2Cr2O7 + (NH4)2SO4 = (NH4)2Cr2O7 + K2SO4 (NH4)2Cr2O7 →(t) Cr2O3 + N2↑ + 4H2O3. Самый чистый азот можно получить разложением азидов металлов: 2NaN3 →(t) 2Na + 3N2↑4. Так называемый «воздушный», или «атмосферный» азот, то есть смесь азота с благородными газами, получают путём реакции воздуха с раскалённым коксом: O2+ 4N2 + 2C → 2CO + 4N25. Пропускание аммиака над оксидом меди (II) при температуре ~700°С: 2NH3 + 3CuO → N2↑ + 3H2O + 3CuМолекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха. Этим методом можно получить и «атмосферный азот».

Соединения азота: Степени окисления азота в соединениях −3, −2, −1, +1, +2, +3, +4, +5.Соединения азота в степени окисления −3 представлены нитридами, из которых практически наиболее важен аммиак; Соединения азота в степени окисления −2 менее характерны, представлены пернитридами, из которых самый важный пернитрид водорода N2H4 или гидразин; Соединения азота в степени окисления −1 NH2OH (гидроксиламин) — неустойчивое основание, применяющееся, наряду с солями гидроксиламмония, в органическом синтезе; Соединения азота в степени окисления +1 оксид азота (I) N2O (закись азота, веселящий газ); Соединения азота в степени окисления +2 оксид азота (II) NO (монооксид азота); Соединения азота в степени окисления +3 оксид азота (III) N2O3, азотистая кислота, Соединения азота в степени окисления +4 оксид азота (IV) NO2 (диоксид азота, бурый газ); Соединения азота в степени окисления +5 — оксид азота (V) N2O5, азотная кислота и её соли — нитраты, и др.

Аммиак Молекула аммиака имеет форму пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N-H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4. Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде. Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N-H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4. Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.

Физические свойства аммиака Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. В холодильной технике носит название R717, где R хладагент, 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.

Химические свойства аммиака Благодаря наличию неподеленной электронной пары он присоединяет протон, образуя ион аммония: NH3 + H+ → NH4+ Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса: NH3 + H2O → NH4+ + OH-Взаимодействуя с кислотами даёт соответствующие соли аммония: NH3 + HNO3 → NH4NO3 Амиды металлов являются аналогами гидроксидов.. Амиды подвергаются в водных растворах необратимому гидролизу:Zn3N2 + 6H2O → 3Zn(OH)2 + 2NH3↑ Фенолфталеин в этих растворах окрашивается в красный цвет, при добавлении кислот происходит их нейтрализация. При нагревании аммиак проявляет восстановительные свойства. Так, он горит в атмосфере кислорода, образуя воду и азот. Окисление аммиака воздухом на платиновом катализаторе даёт оксиды азота, что используется в промышленности для получения азотной кислоты: 4NH3 + 3O2 → 2N2 + 6H20 4NH3 + 5O2 → 4NO + 6H2O На восстановительной способности NH3 основано применение нашатыря NH4Cl для очистки поверхности металла от оксидов при их пайке:3CuO + 2NH4Cl → 3Cu + 3H2O +2HCl + N2 Галогены (хлор, йод) образуют с аммиаком опасные взрывчатые вещества — галогениды азота (хлористый азот, иодистый азот).

Биологическая роль аммиака Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений. Он высоко токсичен для организма, поэтому большая часть аммиака перерабатывается печенью в более безвредное и менее токсичное соединение — карбамид (мочевину). Мочевина затем выводится почками. Аммиак может также использоваться печенью для обратного процесса — ресинтеза аминокислот из аммиака Таким образом, из щавелевоуксусной кислоты получается аспарагиновая, из α-кетоглутаровой — глутаминовая, и т. д.

Физиологическое действие аммиака По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных вызвать отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени. Если чувствуется запах аммиака, то работать без средств защиты уже опасно. В мире максимальная концентрация аммиака в атмосфере (больше 1 миллиграмма на кв. метр) наблюдается на Индо-Гангской равнине, в Центральной долине США и в Южно-Казахстанской области.

Применение аммиака В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.В холодильной технике используется в качестве холодильного агента (R717)

Получение аммиака Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N2(г) + 3H2(г) ↔ 2NH3(г) + 45,9 кДжРеакция происходит с выделением тепла и понижением объёма. Следовательно, исходя из принципа Ле-Шателье, реакцию следует проводить при возможно низких температурах и при высоких давлениях — тогда равновесие будет смещено вправо. Однако скорость реакции при низких температурах ничтожно мала, а при высоких увеличивается скорость обратной реакции. Проведение реакции при очень высоких давлениях требует создания специального, выдерживающего высокое давление оборудования, а значит и больших капиталовложений. Кроме того, равновесие реакции даже при 700 °C устанавливается слишком медленно для практического её использования.Применение катализатора (пористое железо с примесями Al2O3 и K2O) позволило ускорить достижение равновесного состояния. Интересно, что при поиске катализатора на эту роль пробовали более 20 тысяч различных веществ.Учитывая все вышеприведённые факторы, процесс получения аммиака проводят при следующих условиях: температура 500 °C, давление 350 атмосфер, катализатор. Выход аммиака при таких условиях составляет около 30 %. В промышленных условиях использован принцип циркуляции — аммиак удаляют охлаждением, а непрореагировавшие азот и водород возвращают в колонну синтеза. Это оказывается более экономичным, чем достижение более высокого выхода реакции за счёт повышения давления.Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: NH4Cl + NaOH = NH3↑ + NaCl + H2O.

Оксид азота (I) Оксид азота, N2ON2OОксид азота N2O — бесцветный газ со слабым запахом, растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. При нагревании разлагается на азот и кислород. При высоких концентрациях N2O возбуждает нервную систему («веселящий газ»). В медицине N2O применяют как слабое средство для наркоза.

Оксид азота (II) Оксид азота, NONOОксид азота NO — бесветный газ, незначительно растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. Оксид азота (II) — очень реакционноспособное соединение, может вступать в реакции присоединения с рядом солей (нитрозосоли), с галогенами (напр., нитрозилхлорид NOCl), органическими соединениями. При обычной температуре NO соединяется с кислородом с образованием NO2. Оксид NO получают каталитическим окислением при производстве азотной кислоты.

Оксид азота (III) N2O3Оксид N2O3 (азотистый ангидрид) неустойчив при обычных условиях, взаимодействует с водой, образуя азотистую кислоту HNO2.

Оксид азота (IV) Оксид азота , NO2Оксид азота,(NO2)2 или N2O4NО2, N2O4(IV)Оксид азота NО2 — бурый газ, токсичен, тяжелее воздуха, легко сжижается. При комнатной температуре NО2 находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:2NO2 + Н2О = HNO3 + HNO2 и растворами щелочей:2NO2 + 2NaOH = NaNO3 + NaNO2 + H2ОСильный окислитель. Многие вещества (уголь, сера, фосфор, органические соединения) могут гореть в NО2. Этот оксид окисляет SО2 до SO3, на этой реакции основан нитрозный метод получения серной кислоты. Раздражает дыхательные пути, при больших концентрациях появляется отёк легких.
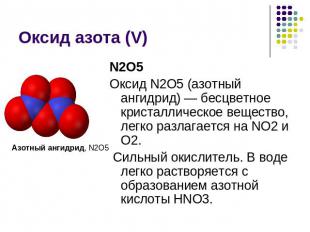
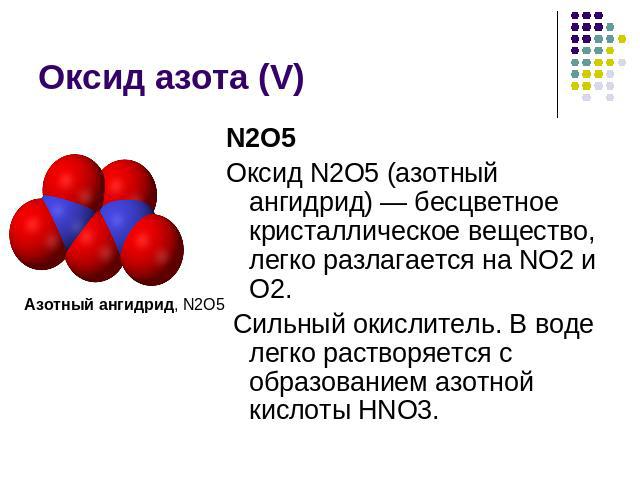
Оксид азота (V) Азотный ангидрид, N2O5N2O5Оксид N2O5 (азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NО2 и О2. Сильный окислитель. В воде легко растворяется с образованием азотной кислоты HNO3.