Презентация на тему: Азот и его соединения

Уважаемые гости!!! Вас приветствуют учащиеся 9 «М»класса и учитель химии Баймашкина Татьяна Александровна

Пять знаменитых химиков XVIII в. дали некоему неметаллу, который в виде простого вещества представляет собой газ и состоит из двухатомных молекул, пять разных имен. - «ядовитый воздух» - «дефлогистированный воздух» - «испорченный воздух» - «удушливый воздух» - «безжизненный воздух» В 1772 году шотландский химик, ботаник и врач Даниел Резерфорд В 1772 году английский химик Джозеф Пристли В 1773 году шведский химик- аптекарь Карл Шееле В 1774 году английский химик Генри Кавендиш В 1776 году французский химик Антуан Лавуазье О каком неметалле идет речь?


Цель урока: Обобщить свойства азота и его соединений, выявить характерные свойства этих соединений, обусловленные наличием в их составе азота в различных степенях окисления.

Парадоксы названия Что означает в переводе с греческого «азот»? Каково латинское название азота? Что оно означает в переводе на русский язык? Каково содержание азота в атмосфере? Почему же азот называют «безжизненным»?
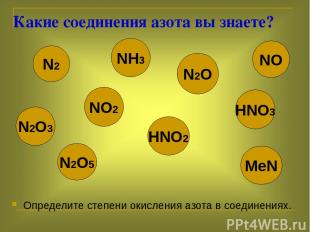
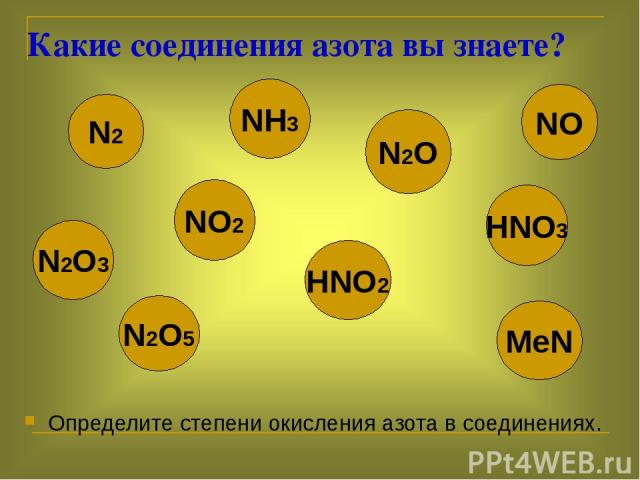
Какие соединения азота вы знаете? Определите степени окисления азота в соединениях. N2 NH3 N2O N2O3 NO2 HNO2 NO N2O5 MeN HNO3

Каковы физические свойства азота? Почему азот химически инертен при обычных условиях? При каких условиях и с какими веществами он взаимодействует? N2

NH3 «летучая щелочь», «щелочной воздух» Раствор аммиака в воде – нашатырный спирт, 10% раствор аммиака. Но почему спирт? Латинское spiritus означает «дух», «душа». Очевидно химик растворивший в воде аммиак, полученный из нашатыря (NH4Cl), назвал осторо пахнущую жидкость «душой нашатыря». В 1774 г. Английский химик Джозеф Пристли получил газообразный аммиак смешав порошки хлорида аммония и гидроксида кальция . Напишите уравнение реакции. Когда ученый попытался собрать аммиак путем вытеснения жидкости из перевернутого сосуда, то газ растворялся в воде. Как Пристли удалось собрать газ?

Растворение аммиака в воде. Окисление аммиака.
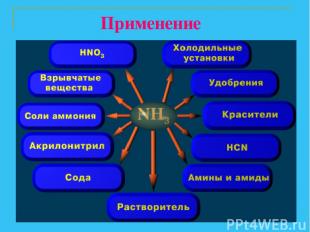
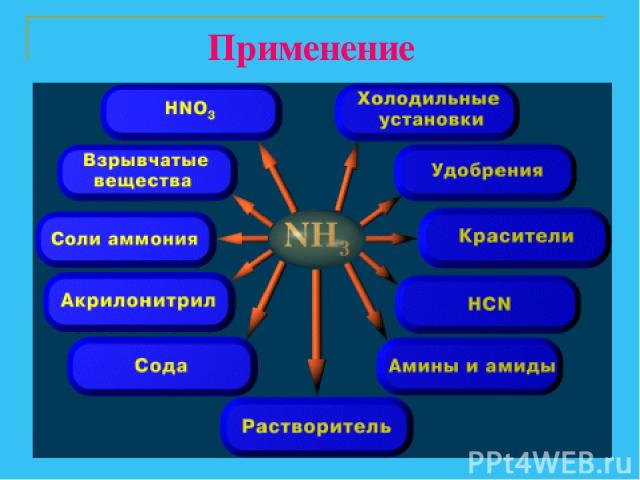
Применение

Оксидов у азота – пять. И нам давно пора уж знать, Их нравы, вкусы, настроенье, Манеру жизни, поведенье.

Этот оксид был известен еще в XIX веке. Его действие зависит от возраста человека, концентрации газа и принятой дозы. Американский химик Джеймс Вудхауз в 1800 г. изучал взаимодействие серы с нагретым раствором нитрита натрия в формамиде. Внезапно началась бурная реакция с выделением какого-то газа со слабым приятным запахом. Ученому вдруг стало весело, и он пустился в пляс, распевая песни. Почти в то же самое время английский химик Гемфри Дэви проводил термическое разложение нитрата аммония. Как потом он вспоминал, помощник слишком близко наклонился к установке и несколько раз вдохнул газ с приятным запахом, выходивший из реторты. Вдруг помощник разразился беспричинным смехом, стал судорожно двигаться, опрокидывая стулья, а потом свалился в углу комнаты и тут же уснул. Какой газ получили Вудхауз и Дэви?

Оксид азота (I) монооксид диазота «веселящий газ» Бесцветный газ со слабым приятным запахом и сладковатым привкусом. В смеси с воздухом он действует на людей по-разному – кого «веселит», а кого погружает в сон. Применяют в медицине, обеспечивая безопасный наркоз. Несолеобразующий оксид. Можно получить термическим разложением нитрата аммония. Данный оксид неустойчив и легко разлагается на азот и кислород. N2O Напишите уравнения упомянутых реакций

Оксид азота (II) – монооксид азота Легко окисляется кислородом воздуха до оксида азота (IV) Восстанавливается водородом до свободного азота. NO Напишите уравнения упомянутых реакций

Знаете ли вы, что NO образуется также при грозовом разряде в атмосфере. Статистика утверждает, что в атмосфере нашей планеты ежегодно вспыхивают три с лишним миллиарда молний. Мощность отдельных разрядов достигает 200 млн. киловатт, а воздух разогревается при этом (локально) до 20 000 К , хотя разряд молнии длится десятитысячную долю секунды. При такой чудовищной температуре молекулы азота и кислорода разрываются на атомы, которые активно и легко соединяются друг с другом, образуя молекулы оксида азота (II). Молекулы NO быстро окисляются на воздухе до более стабильных молекул оксида азота (IV). Этот атмосферный процесс во многом помогает решать проблему связывания свободного азота.

Оксид азота (III) Жидкость темно-синего цвета. Кислотный оксид. Получают охлаждением смеси оксидов азота (II) и (IV). При взаимодействии с водой образуются азотистая и азотная кислоты. Оксид взаимодействует со щелочью. N2O3 Составьте уравнения реакций

Оксид азота (IV) – диоксид азота, «бурый газ», «лисий хвост» Газ с резким запахом, хорошо растворим в воде. !!! Токсичен. Получают окислением NO и взаимодействием концентрирован-ной азотной кислоты с медью. Если это кислотный оксид, то с какими веществами он будет взаимодействовать? Напишите уравнения реакций. NO2

Знаете ли вы, что «лисий хвост» — жаргонное название выбросов в атмосферу оксидов азота на химических предприятиях (иногда — из выхлопных труб автомобилей). Название происходит от оранжево-бурого цвета диоксида азота. При низких температурах диоксид азота димеризуется и становится бесцветным. В летний сезон «лисьи хвосты» наиболее заметны, так как в выбросах возрастает концентрация мономерной формы.

Оксид азота (V) Кислотный оксид. Белое твердое вещество, хорошо растворимое в воде. Получают осторожным обезвоживанием азотной кислоты с помощью оксида фосфора (V) или действием озона на оксид азота (IV). Взаимодействует с водой и щелочами. Очень неустойчив, разлагается со взрывом на кислород и оксид азота (IV). Напишите уравнения реакций. N2O5

Опыты Каблукова Российский химик Иван Каблуков славился своими чудачествами. Например, он подписывался не иначе как «Каблук Иван». В 1882-1888 г.г. он преподавал на Высших женских курсах в Москве, а с 1884г. - в Московском университете. Однажды он показал своим студентам удивительный опыт с четырьмя газометрами, наполненными ртутью, где хранились четыре газа – два бесцветных, а два другие – красно-бурого цвета. Каблуков пропускал поочередно эти газы над раскаленной медной стружкой и показывал, что вне зависимости от состава исходного газа получаются одни и те же продукты: оксид меди (I) Cu2O и азот N2. Студенты терялись в догадках – как такое стало возможно? Помогите найти объяснение опытам Каблукова.

N2 O + 2Сu = Cu2O + N2 ; 2NO + 4Сu = 2Cu2O + N2; 2N O2 + 8Сu =4Cu2O + N2; N2 O3 + 6Сu = 3Cu2O + N2. Газометры были наполнены оксидами азота состава N2O (бесцветный), NO (бесцветный), NO2 (бурый), N2O3 (при комнатной температуре на 90% разлагается на NO и NO2, поэтому тоже приобретает бурый цвет). Все эти газы реагируют с медью, превращая ее в Cu2O.

HNO3 Азотная кислота Какую степень окисления имеет азот в азотной кислоте? Окислителем или восстановителем может быть кислота? Почему? В чем заключается особая опасность азотной кислоты?

Из-за своих окислительных свойств азотная кислота требует большой осторожности в обращении. При соприкосновении с нею многие органические вещества окисляются с выделением большого количества теплоты и поэтому воспламеняются и взрываются. Например, скипидар вспыхивает, тлеющая лучинка начинает гореть, на одежде образуются дыры, а на коже – язвы. При этом кожа окрашивается в желтый цвет (качественная реакция на белок). Попавшую на кожу серную кислоту можно успеть смыть большим количеством воды, а азотная кислота действует практически мгновенно).
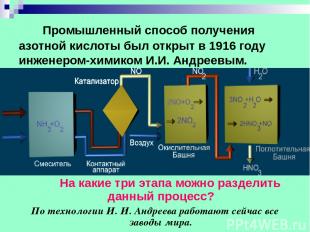
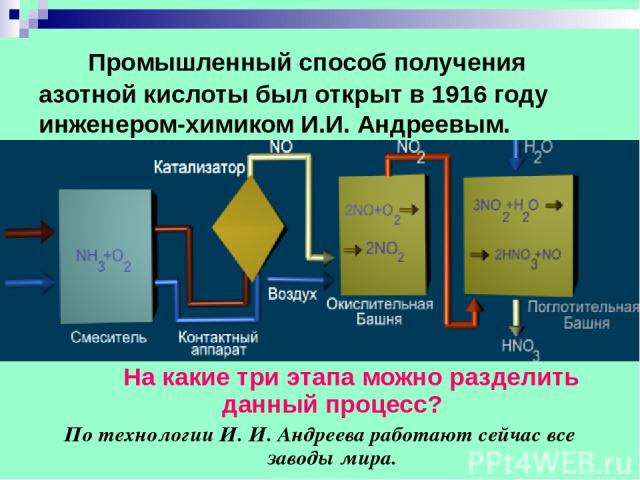
Промышленный способ получения азотной кислоты был открыт в 1916 году инженером-химиком И.И. Андреевым. На какие три этапа можно разделить данный процесс? По технологии И. И. Андреева работают сейчас все заводы мира.

Знаете ли вы, что азотная кислота была упомянута арабским химиком Джабиром ибн Хайяном (Гебером) в VIII в. в его трудах, а для производственных целей её стали получать лишь в XV в. В одной старинной русской книге, датированной 1675г., было сказано, что на изготовление «крепкой водки» было дано полпуда железного купороса и десять фунтов селитры. Позднее в работах М.В. Ломоносова мы встречаем название «селитряная дымистая водка». «Крепкой водкой», «селитряной дымистой водкой», «зияющей красным газом кислотой» называли в России XVII и XVIII в.в. азотную кислоту. Название «крепкая водка» произошло от алхимического «аква фортис» - «крепкая, сильная вода». С 1720 г. для производства азотной кислоты вместо железного купороса стали применять серную кислоту: 2KNO3 + H2SO4 = 2 HNO3 + K2SO4 Если применять концентрированную серную кислоту и чистую селитру, то «водка» получалась «крепкой» – 96-98%.

Свойства азотной кислоты

Какой металл растворяется только в «царской водке»? Mg Zn Fe Au Являются ли винным спиртом вещества, которые 100 – 200 лет тому назад называли «вторичной водой», «царской водкой», «королевской водкой»? Под такими названиями известен один и тот же реактив - смесь концентрированных кислот : одного объёма азотной кислоты с тремя объёмами хлороводородной кислоты. М.В. Ломоносов называл этот реактив «королевской водкой», но чаще в литературе встречается термин «царская водка», причём первые упоминания на этот счёт были уже в сочинениях арабских алхимиков VIIIв. Своё название «царская водка» получила благодаря способности взаимодействовать с золотом – «царём металлов». Полагают, что эту способность впервые обнаружил в 1270 г. итальянский монах-францисканец, философ, алхимик и кардинал Джованни Фиданци – «Бонавентура».

Знаете ли вы, что от «царской водки» трагически погиб Александр Николаевич Радищев. В начале сентября 1802 г. он очень плохо себя чувствовал и принял лекарство, которое надо было запить водой. На столе стоял стакан с прозрачной бесцветной жидкостью, которую Радищев выпил залпом. Но это была не вода, а «царская водка», приготовленная его старшим сыном для чистки старых эполет. На следующий день Радищева не стало…

Разбирая старые бумаги в бабушкином чулане, школьники нашли старый конспект по химии, испорченный огнём. Сохранилось только следующее: N2 O + NaOH NO + NaOH 2N O2 + 2NaOH = N2 O3 + 2NaOH = N2 O5 + 2NaOH = Восстановите записи на обгорелых страницах.

N2 O + NaOH NO + NaOH 2N O2 + 2NaOH = 2NaNO2 +H2O N2 O3 + 2NaOH = NaNO3 +NaNO2 + H2O N2 O5 + 2NaOH = 2NaNO3 + Н2О

Ошибка властителя Лахора. Властитель индийского города Лахора по имени Ранжит – Сингх в 1811г. хвастался перед другими владыками Индии, Персии и Афганистана, что его голубой алмаз не подвержен действию никаких жидких веществ. Афганский шах Шуджа сказал, что готов поспорить (а ставка в споре – сам голубой алмаз), что его придворный факир – алхимик может за сутки уменьшить массу алмаза, погрузив его в жидкий «алкагест» (мифический универсальный растворитель). Предложение было принято, и придворные двух властителей уселись вокруг сосуда с «алкагестом», куда был погружен алмаз. Вскоре стало заметно, что камень покрылся пузырьками, а жидкость стала жёлтой. По истечении суток алмаз снова взвесили, и оказалось, что он потерял в весе около одного карата (0,2г). К огорчению Ранжит – Сингха, алмаз пришлось отдать шаху Шудже. Правда, через два года силой оружия алмаз был возвращён в Лахор, но это уже другая история… Какой состав имел «алкагест»?

На алмазы разрушительно действует концентрированная азотная кислота. При этом алмаз медленно превращается в оксид углерода (IV). Жёлтый цвет жидкости («алкагесту») придаёт оксид азота (IV): С + 4HNO3 = СO2 + 4N O2 + 2H2O

Домашнее задание: NH3 ← N2 → Li 3N → NH3 → NO → NO2 → HNO3 →Сu(NO3)2 ↓ NO ↓ NH4NO3 NO2 Составьте уравнения возможных реакций

Роль азотных соединений в жизни человека и общества велика, а применение разнообразно. Азот – основа жизни на земле. На Земле постоянно происходят процессы превращения веществ живой и неживой природы. В результате этих превращений неорганические вещества неживой природы – соли аммония, нитраты, могут превращаться в сложные органические вещества – белки. А белки – это основа всего живого. В белках содержится 18% азота. «Жизнь – есть способ существования белковых тел» Ф. Энгельс Без азота → нет белка →без белка →нет жизни.