Презентация на тему: Азотсодержащие органические соединения

Азотсодержащие органические соединения

Амины Амины – органические соединения, которые можно рассматривать как производные аммиака, в котором атомы водорода (один или несколько) замещены на углеводородные радикалы.

Амины бывают алифатические, ароматические, алициклические и гетероциклические. Они подразделяются на первичные, вторичные и третичные.Например, первичный: CH3-NH2 –метиламин; вторичный: CH3-NH-CH3 – диметиламин; третичный: CH3-N-CH3 – триметиламин; CH3Четвертичные амины – это органические аналоги неорганических аммониевых солей: [R4N]+ Cl-

Физические свойства аминов Простейшие алифатические амины при нормальных условиях представляют собой газы или жидкости с низкой температурой кипения, обладающие резким запахом. Первые представители ряда аминов растворяются в воде, но по мере роста углеродного скелета их растворимость в воде уменьшается. Также амины растворимы в органических растворителях.

Способы получения аминов Нагревание алкилгалогенидов с аммиаком под давлением: Например,CH3Cl + NH3 CH3NH2 + HCl NaOH[CH3NH3]Cl CH3NH2
![2. Восстановление нитросоединений (ароматические амины):Например,C6H5NO2 + 6[H] 2. Восстановление нитросоединений (ароматические амины):Например,C6H5NO2 + 6[H]](/images/937/26186/310/img5.jpg)
2. Восстановление нитросоединений (ароматические амины):Например,C6H5NO2 + 6[H] C6H5NH2 + 2H2O

3. Пропускание смеси спирта и аммиака над поверхностью катализатора (низшие амины):Например, Al2O3CH3OH + NH3 CH3NH2 + H2O 400oC
![Химические свойства аминов Основные свойства:CH3NH2 + H2SO4 [CH3NH3]HSO4C6H5NH2 Химические свойства аминов Основные свойства:CH3NH2 + H2SO4 [CH3NH3]HSO4C6H5NH2](/images/937/26186/310/img7.jpg)
Химические свойства аминов Основные свойства:CH3NH2 + H2SO4 [CH3NH3]HSO4C6H5NH2 + HCl [C6H5NH3]Cl2. Горение:4C2H5NH2 +15O2 8CO2 + 2N2 + 14H2O

3. Реакции с азотистой кислотой: а) первичные алифатические:R-NH2 + NaNO2 + HCl R-OH + N2 +NaCl + H2Oб) первичные ароматические:C6H5NH2 + NaNO2 + HCl [C6H5-N=N]+Cl- +NaCl + H2O в) вторичные алифатические и ароматические:R2NH + NaNO2 + HCl R2N-N=O + NaCl + H2O
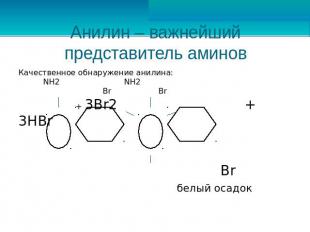
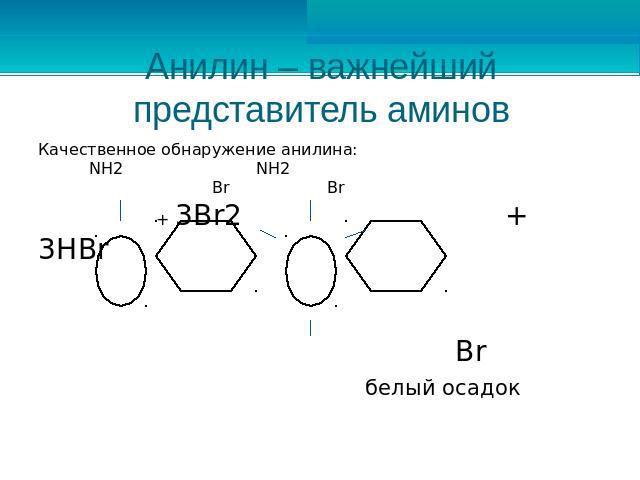
Анилин – важнейший представитель аминов Качественное обнаружение анилина: NH2 NH2 Br Br + 3Br2 + 3HBr Br белый осадок

Аминокислоты Аминокислоты – это органические соединения, в состав которых входят карбоксильная группа – COOH и аминогруппа – NH2. В зависимости от расположения обеих функциональных групп различают α-,β-,γ-аминокислоты и т. д. В природе встречаются только α-аминокислоты.

Основные группы природных аминокислот: Алифатические предельные аминокислоты (глицин, аланин);Серосодержащие аминокислоты (цистеин);Аминокислоты с алифатической гидроксильной группой (серин);Ароматические аминокислоты (фенилаланин, тирозин);Аминокислоты с кислотным радикалом (глутаминовая кислота);Аминокислоты с основным радикалом (лизин).

Физические свойства аминокислот Твёрдые кристаллические вещества, хорошо растворимые в воде и мало растворимые в органических растворителях. Многие аминокислоты имеют сладкий вкус. Они плавятся при высоких температурах и обычно при этом разлагаются. В парообразное состояние переходить не могут.

Способы получения аминокислот: Гидролиз белковых веществ.Замещение галогена на аминогруппу в соответствующих галогенокислотах: -HClR-CH-COOH + NH3 R-CH-COOH R-CH-COOH Cl NH3+Cl- NH2

Химические свойства аминокислот 1.Аминокислоты – амфотерные соединения, они реагируют как с кислотами, так и с основаниями:H2N-CH2-COOH + HCl Cl[H3N-CH2-COOH]H2N-CH2-COOH + NaOH H2N-COONa + H2O2.При растворении аминокислот в воде образуется внутренняя соль, молекула которой представляет собой биполярный ион:H2N-CH2-COOH +H3N-CH2-COO-

3. Взаимодействие со спиртами: HClH2N-CH(R)- COOH + R’OH H2N-CH(R)-COOR’ + H2O

ПептидыВажнейшее свойство аминокислот – их способность к конденсации с образованием пептидов. R O R’ OH2N-CH-C-OH + H-NH-CH-C-OH R O R’ O H2N-CH-C-NH-CH-C-OH + H2O

Качественные реакции на аминокислоты Все аминокислоты окисляются нингидрином с образованием продуктов, окрашенных в сине-фиолетовый цвет.При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрирование бензольного кольца и образуются соединения, окрашенные в жёлтый цвет. Эта реакция называется ксантопротеиновой.

Использованная литература Н. Кузьмнеко, В. Ерёмин, В. Попков «Химия для школьников старших классов и поступающих в вузы».





![Способы получения аминов Нагревание алкилгалогенидов с аммиаком под давлением: Например,CH3Cl + NH3 CH3NH2 + HCl NaOH[CH3NH3]Cl CH3NH2 Способы получения аминов Нагревание алкилгалогенидов с аммиаком под давлением: Например,CH3Cl + NH3 CH3NH2 + HCl NaOH[CH3NH3]Cl CH3NH2](/images/937/26186/640/img4.jpg)
![2. Восстановление нитросоединений (ароматические амины):Например,C6H5NO2 + 6[H] C6H5NH2 + 2H2O 2. Восстановление нитросоединений (ароматические амины):Например,C6H5NO2 + 6[H] C6H5NH2 + 2H2O](/images/937/26186/640/img5.jpg)

![Химические свойства аминов Основные свойства:CH3NH2 + H2SO4 [CH3NH3]HSO4C6H5NH2 + HCl [C6H5NH3]Cl2. Горение:4C2H5NH2 +15O2 8CO2 + 2N2 + 14H2O Химические свойства аминов Основные свойства:CH3NH2 + H2SO4 [CH3NH3]HSO4C6H5NH2 + HCl [C6H5NH3]Cl2. Горение:4C2H5NH2 +15O2 8CO2 + 2N2 + 14H2O](/images/937/26186/640/img7.jpg)
![3. Реакции с азотистой кислотой: а) первичные алифатические:R-NH2 + NaNO2 + HCl R-OH + N2 +NaCl + H2Oб) первичные ароматические:C6H5NH2 + NaNO2 + HCl [C6H5-N=N]+Cl- +NaCl + H2O в) вторичные алифатические и ароматические:R2NH + NaNO2 + HCl R2N-N=O + … 3. Реакции с азотистой кислотой: а) первичные алифатические:R-NH2 + NaNO2 + HCl R-OH + N2 +NaCl + H2Oб) первичные ароматические:C6H5NH2 + NaNO2 + HCl [C6H5-N=N]+Cl- +NaCl + H2O в) вторичные алифатические и ароматические:R2NH + NaNO2 + HCl R2N-N=O + …](/images/937/26186/640/img8.jpg)




![Химические свойства аминокислот 1.Аминокислоты – амфотерные соединения, они реагируют как с кислотами, так и с основаниями:H2N-CH2-COOH + HCl Cl[H3N-CH2-COOH]H2N-CH2-COOH + NaOH H2N-COONa + H2O2.При растворении аминокислот в воде образуется внутренн… Химические свойства аминокислот 1.Аминокислоты – амфотерные соединения, они реагируют как с кислотами, так и с основаниями:H2N-CH2-COOH + HCl Cl[H3N-CH2-COOH]H2N-CH2-COOH + NaOH H2N-COONa + H2O2.При растворении аминокислот в воде образуется внутренн…](/images/937/26186/640/img14.jpg)