Презентация на тему: Галогены. Общая характеристика галогенов

Галогены.Общая характеристика галогенов Учитель химии МБОУ СОШ № 9 МО ЩР станица НовощербиновскаяСтепучева Ольга Викторовна

Цель урока:Повторить свойства металлов и неметаллов Изучить строениеатомов, свойства галогенов на основании их сравнительной характеристики.

1 вариант – неметаллы 13, 15 2 вариант – металлы 1, 2, 3, 6, 8, 9, 12, 14

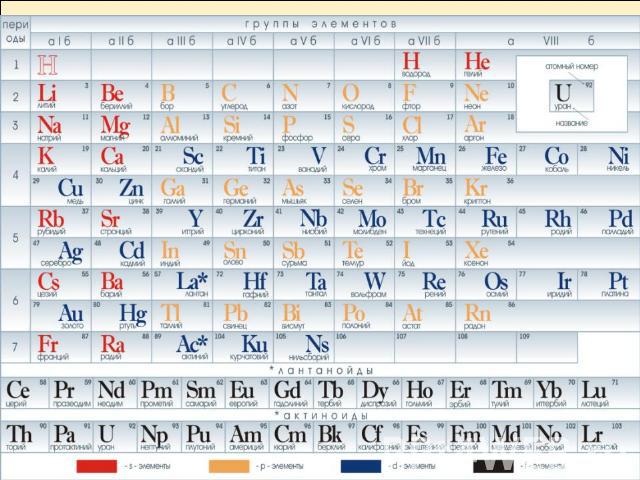
Галогены расположены в главной подгруппе VII группы ПСХЭ Д.И. Менделеева

Галогены расположены в главной подгруппе VII группы ПСХЭ Д.И. Менделеева

Галогены расположены в главной подгруппе VII группы ПСХЭ Д.И. Менделеева

Галогены расположены в главной подгруппе VII группы ПСХЭ Д.И. Менделеева

«рождающие соли»

Распространенность галогенов в природе

Физические свойстваУвеличивается плотность

Физические свойстваУвеличивается плотностьПовышаются температурыкипения и плавления

Физические свойстваУвеличивается плотностьПовышаются температурыкипения и плавленияУсиливается интенсивность окраски

Фтор F2Ядовитый газ светло- зелёного цвета

CI2 - Ядовитыйгаз жёлто-зеленого цвета

Br2Токсичнаятяжёлаяжидкостькрасно- бурого цвета

I2 –Твёрдое кристаллическое веществос металлическим блескомПри нагревании образует пары фиолетового цвета

Ответьте на вопросы.Число электронов на внешнем энергетическом уровне атома; Изменение радиуса атомов и окислительно-восстановительных свойств галогенов в подгруппе; Возможные степени окисления. Тип химической связиТип кристаллической решетки

Проверка:На внешнем энергетическом уровне галогены содержат 7 электронов.В главной подгруппе с увеличением зарядов ядер, увеличиваются радиусы атомов, нарастают восстановительные свойства.Возможные степени окисления: -1, +7.Ковалентная неполярная связьМолекулярная кристаллическая решетка.

Химические свойстваГалогены-окислители
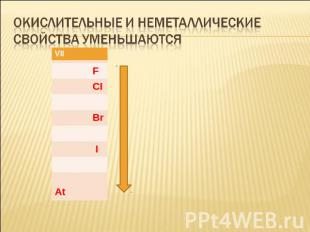
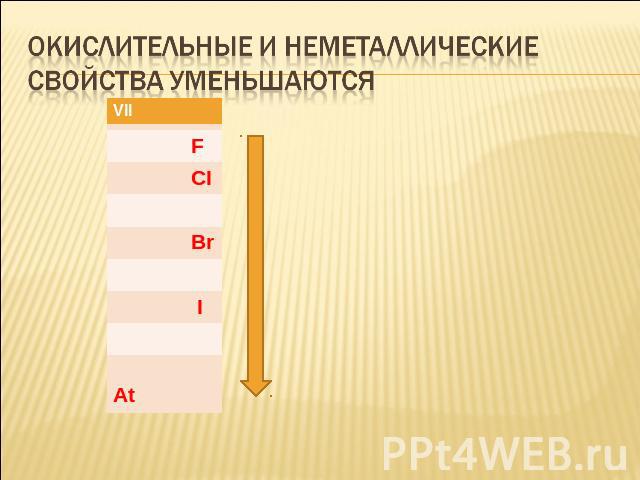
Окислительные и неметаллические свойства уменьшаются

Более активный галоген вытесняет менее активный из его соединений с металлами и водородомФтор – самыйсильный неметалл

Летучие водородные соединенияСила кислот увеличивается

Л. О. №2Вытеснение одних галогенов другими из их соединенийОформите результаты работы в виде таблицыЗапишите уравнения реакцийСделайте вывод . Как изменяются окислительные свойства галогенов?

Л. О. №3Растворимость йода в органических растворителях Оформите результаты работы в виде таблицыЗапишите уравнения реакций.Сделайте вывод о растворимости галогенов.

Вопросы и заданияПеречислите галогены.Фтор, хлор, бром, йод, астат.Где в ПСХЭ располагаются галогены? в VII группе, главной подгруппе. Чему равно число валентных электронов в атомах галогенов ?Число валентных электронов равно семи.

Вопросы и задания Сопоставьте :Хлор красно – бурая жидкостьБром светло – зеленый газЙод жёлто – зелёный газФтор твёрдый с металлическим блеском пары фиолетового цвета

Вопросы и заданияДополните:Самый сильный неметалл – фтор.Самая сильная бескислородная кислота – HI.Как изменяются окислительные свойства галогенов?Уменьшаются в ряду F CI Br I

Домашнее задание Домашнее задание

Изображение хлора и брома:Изображение хлора и брома:http://ru.wikipedia.org/wiki/Изображение периодической системы д.И. Менделеева:http://steelbros.ru/threads/%D… Изображение морского прибоя:http://misterforex.ru/gdefon/w…Изображение флюорита:http://geo.web.ru/