Презентация на тему: Аминокислоты. История их открытия

Аминокислоты. История их открытия.Выполнила студентка ХБ-4 Ширяева София

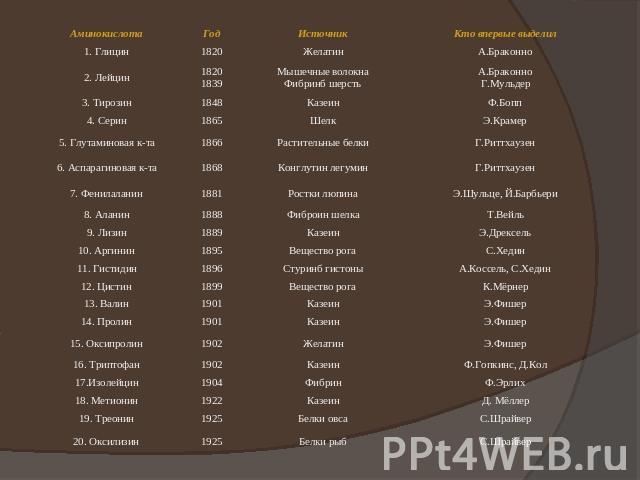
История открытия К началу XIX столетия появляются первые работы по химическому изучению белков. Уже в 1803 г. Дж. Дальтон дает первые формулы белков - альбумина и желатина - как веществ, содержащих азот. В 1810 г. Ж. Гей-Люссак проводит химические анализы белков - фибрина крови, казеина и отмечает сходство их элементного состава. Решающее значение для понимания химической природы белков имело выделение при их гидролизе аминокислот. Вероятно, первым это сделал А. Браконно в 1820 г., когда, действуя на белки серной кислотой, при кипячении он получил «клеевой сахар», или гликокол (глицин), при гидролизе фибрина из мяса - лейцин и при разложении шерсти - также лейцин и смесь других продуктов гидролиза. Первой открытой аминокислотой был, видимо, аспарагин, выделенный Л. Вокленом из сока спаржи Asparagus (1806). В это же время Ж. Пруст получил лейцин при разложении сыра и творога. Затем из продуктов гидролиза белка были выделены многие другие аминокислоты(табл. 1).


Первая концепция строения белков принадлежит голландскому химику Г. Мульдеру (1836). Основываясь на теории радикалов, он сформулировал понятие о минимальной структурной единице, входящей в состав всех белков. Эту единицу, которой приписывался состав 2C8H12N2 + 50, Г. Мульдер назвал протеином (Рг), а свою концепцию - теорией протеина. Позднее состав протеина был уточнен - C40H62N10O12; дополнительно к протеинным единицам некоторые белки содержали серу и фосфор. Формула белков, предложенная Мульдером в 1838 г., выглядела так: Г. Мульдер пользовался структурными формулами и для обозначения ряда физиологических процессов. В своем учебнике физиологической химии (1844) он рассматривал дыхание как окисление протеина, пищеварение - как перестройку белка с изменением содержания S, Р, Са и т. п.Работы Г. Мульдера способствовали широкому распространению взглядов о единстве всех белков, их фундаментальном значении в мире живой природы. Однако вскоре наступают трудные времена для теории протеина. В 1846 г. Н. Э. Лясковский, работавший в лаборатории Ю. Либиха, доказал неточность многих приведенных Г. Мульдером анализов. Свои сомнения в правильности теории публично высказал Ю. Либих. Г. Мульдер пытался корректировать формулу протеина , но в конце концов уступил под натиском новых фактов и открытий.

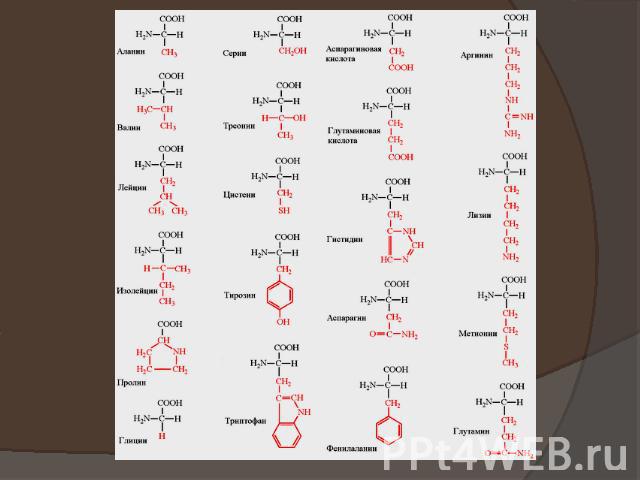
Структура и свойства аминокислотОбщую структурную формулу любой аминокислоты можно представить следующим образом: карбоксильная группа (— СООН) и аминогруппа (— NH2) связаны с одним и тем же a-атомом углерода (счет атомов ведется от карбоксильной группы с помощью букв греческого алфавита — α, β, γ и т. д.).

КлассификацияПо радикалуНеполярные: глицин, аланин, валин, изолейцин, лейцин, пролин, метионин, фенилаланин, триптофанПолярные незаряженные (заряды скомпенсированы) pH=7: серин, треонин, цистеин, аспарагин, глутамин, тирозинПолярные заряженные отрицательно при pH<7: аспартат, глутаматПолярные заряженные положительно при pH>7: лизин, аргинин, гистидинПо функциональным группамАлифатическиеМоноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцинОксимоноаминокарбоновые: серин, треонинМоноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный зарядАмиды моноаминодикарбоновых: аспарагин, глутаминДиаминомонокарбоновые: лизин, аргинин, несут в растворе положительный зарядСеросодержащие: цистеин, метионинАроматические: фенилаланин, тирозин, триптофан, (гистидин)Гетероциклические: триптофан, гистидин, пролинИминокислоты: пролин

Все входящие в состав живых организмов α-аминокислоты, кроме глицина, содержат асимметричный атом углерода (треонин и изолейцин содержат два асимметричных атома) и обладают оптической активностью. Почти все встречающиеся в природе α-аминокислоты имеют L-форму.

Аминокислоты — бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом.Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так и основные свойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами. Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.Изоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.

Способы полученияуксусная кислота →хлоруксусная кислота→аминоуксусная кислотаСН3-СООН + Сl2 → СН2-СООН | ClСН2-СООН + NH3 → СН2-СООН | | Сl NH2

Использование аминокислотАминокислоты находят широкое применение в качестве пищевых добавок. Например, лизином, триптофаном, треонином и метионином обогащают корма сельскохозяйственных животных, добавление натриевой соли глутаминовой кислоты (глутамата натрия) придает ряду продуктов мясной вкус.

В смеси или отдельно аминокислоты применяют в медицине, в том числе при нарушениях обмена веществ и заболеваниях органов пищеварения, при некоторых заболеваниях центральной нервной системы (γ-аминомасляная и глутаминовая кислоты, ДОФА).Аминокислоты используются при изготовлении лекарственных препаратов, красителей, в парфюмерной промышленности, в производстве моющих средств, синтетических волокон и пленки и т. д. Для хозяйственных и медицинских нужд аминокислоты получают с помощью микроорганизмов путем так называемого микробиологического синтеза (лизин, триптофан, треонин); их выделяют также из гидролизатов природных белков (пролин, цистеин, аргинин, гистидин). Но наиболее перспективны смешанные способы получения, совмещающие методы химического синтеза и использованиеферментов.

Спасибо за внимание!