Презентация на тему: Характеристика элементов VII группы главной подгруппы. Хлор

Характеристика элементов VII группы главной подгруппыХлорВыполнила Ширяева СофияХБ-5


Характеристика элементов подгруппы VIIA

Характеристические соединения
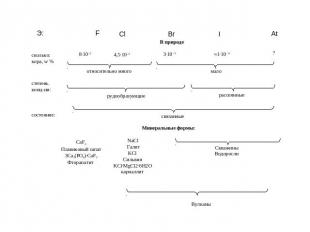

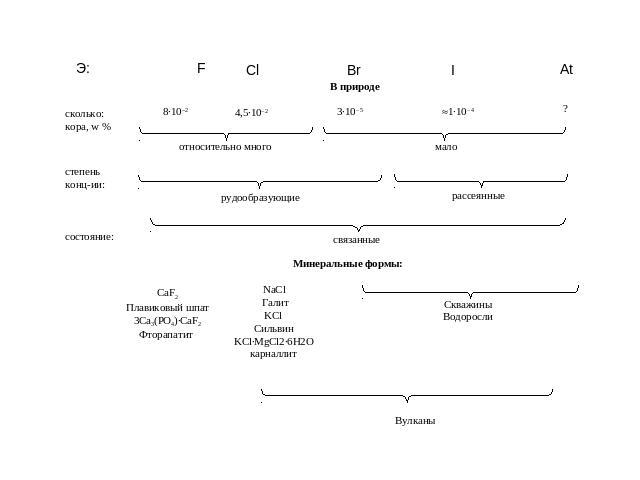
Нахождение в природеВ земной коре хлор - самый распространённый галоген. Поскольку хлор очень активен, в природе он встречается только в виде соединений в составе минералов:Галит (фиолетовый). Саксония-Анхальт, Германия.Галит синий. Нью-Мексико, США

Сильвин KClСильвин, Германия. Музей им. А.Е.ФерсманаСильвин и галит, Соликамск. Музей им. А.Е.ФерсманаСильвинит. Верхнекамское месторождение (Пермский край)Сильвинит или калийная соль. Добыча

Бишофит MgCl2·6H2OБишофит. Минерал Волгоградской области

Карналлит KCl·MgCl2·6Н2OРудник №2, Прикарпатье, УкраинаГалит и карналлит

Каинит KCl·MgSO4·3Н2ОКаинит. Брауншвейг, ГерманияКалуш,Украина

Характеристика химического элементаХлор – элемент VII А группы. Порядковый номер 17Относительная атомная масса: 35,4527 а. е. м. (г/моль)Количество протонов, нейтронов, электронов: 17,18,17Строение атома:

Электронная формула: Типичные степени окисления: -1, 0, +1, +3, +4, +5, +7Энергия ионизации: 1254,9(13,01) кДж/моль (эВ)Сродство к электрону: 349 (кДж/моль)Электроотрицательность по Полингу: 3,20

Характеристика простого веществаТип связи: ковалентная неполярнаяМолекула двухатомнаяИзотопы: 35Cl (75,78 %) и 37Cl(24,22 %) Тип кристаллической решетки: молекулярная

Термодинамические параметры
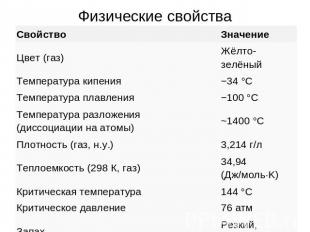
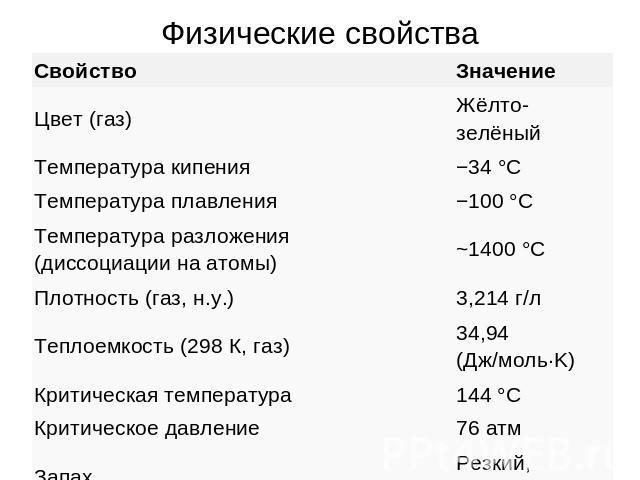
Физические свойства
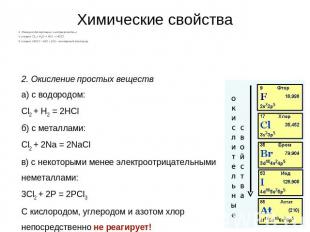
Химические свойства1. Реакция дисмутации («хлорная вода»)1 стадия: Cl2 + H2O = HCl + HOCl2 стадия: HOCl = HCl + [О] – атомарный кислород2. Окисление простых веществa) с водородом:Cl2 + H2 = 2HClб) с металлами:Cl2 + 2Na = 2NaClв) с некоторыми менее электроотрицательными неметаллами:3Cl2 + 2P = 2PCl3С кислородом, углеродом и азотом хлор непосредственно не реагирует!

3. Взаимодействие со сложными веществамиа) с водой: см. выше реакция дисмутацииб) с кислородсодержащими кислотами: не реагирует!в) с растворами щелочей:на холоду: Cl2 + 2NaOH = NaCl + NaClO + H2Oпри нагревании: 3Cl2+ 6 KOH = 5KCl + KClO3 + 3H2Oд) со многими органическими веществами:Cl2 + CH4 = CH3Cl + HClC6H6 + Cl2 = C6H5Cl + HCl

Важнейшие соединения хлораХлороводород, хлористый водород (HCl) Бесцветный, термически устойчивый газ (при н.у.) с резким запахом, дымящий во влажном воздухе, легко растворяется в воде с образованием хлороводородной (соляной) кислоты.При растворении в воде протекают следующие процессы:HClг + H2Oж = H3O+ж + Cl−жПроцесс растворения сильно экзотермичен.Соляная кислота образует соли — хлориды

Свойства соляной кислоты:Очень устойчива к нагреваниюВ воде кислотаСлабый окислитель по протонуПод действием сильных окислителей анион окисляется

Как окислитель реагирует:Mg + 2 HCl → MgCl2 + H2↑Конц. соляная кислота реагирует с медью:2 Cu + 4 HCl → 2 H[CuCl2] + H2↑FeO + 2 HCl → FeCl2 + H2OПри действии сильных окислителей или при электролизе хлороводород проявляет восстановительные свойства:MnO2 + 4 HCl → MnCl2 + Cl2↑ + 2 H2OПри нагревании окисляется кислородом (катализатор — хлорид меди(II) CuCl2):4 HCl + O2 → 2 H2O +2 Cl2↑

Смесь 3v HCl : 1v HNO3 называется «царской водкой». Она способна растворять даже золото и платину. 4 H3O+ + 3 Cl− + NO3− = NOCl + Cl2 + 6 H2OРасстворение идет благодаря высокой концентрации хлорид-ионов :3 Pt + 4 HNO3 + 18 HCl → 3 H2[PtCl6] + 4 NO↑ + 8 H2OДля хлороводорода также характерны реакции присоединения к кратным связям (электрофильное присоединение):R-CH=CH2 + HCl → R-CHCl-CH3R-C≡CH + 2 HCl → R-CCl2-CH3
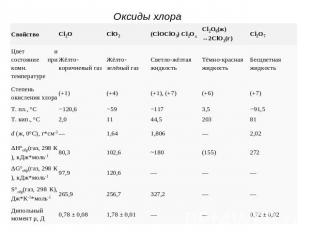
Оксиды хлора

Оксид хлора (I), оксид дихлора, ангидрид хлорноватистой кислоты (Cl2O)В нормальных условиях представляет собой буровато-жёлтый газ с характерным запахом, напоминающим запах хлора. При температурах ниже 2 °C — жидкость золотисто-красного цвета. Ядовит: поражает дыхательные пути. При больших концентрациях взрывоопасен. Самопроизвольно медленно разлагается:Кислотный и солеобразующий. Хорошо растворим в воде с образованием слабой хлорноватистой кислоты:Быстро реагирует со щелочами:Cl2O + 2NaOH(разб.) = 2NaClO + H2O

Диоксид хлора, оксид хлора (IV), (ClO2) В нормальных условиях газ красновато-жёлтого цвета, с характерным запахом. При температурах ниже 10 °C ClO2 представляет собой жидкость красно-коричневого цвета. Малоустойчив, взрывается на свету. Кислотный оксид. При растворении в воде образуются хлористая и хлорноватая кислоты (реакция диспропорционирования). Разбавленные растворы на свету медленно разлагаются:

Проявляет окислительно-восстановительные свойства.2ClO2 + 5H2SO4 (разб.) + 10FeSO4 = 5Fe2(SO4)3 + 2HCl + 4H2OClO2 + O3 = ClO3 + O2ClO2 + 2NaOHхол. = NaClO2 + NaClO3 + H2O ClO2 реагирует со многими с органическими соединениями и выступает окислителем средней силы. Выгодным считается обеззараживание воды при помощи диоксида хлора. Но в наши дни этот метод практически не применяется.

Очень слабая одноосновная кислота, в которой хлор имеет степень окисления +1. Существует лишь в растворах. В водных растворах хлорноватистая кислота частично распадается на протон и гипохлорит-анион ClO−:Неустойчива. Хлорноватистая кислота и её соли — гипохлориты — сильные окислители. Реагирует с соляной кислотой HCl, образуя молекулярный хлор:

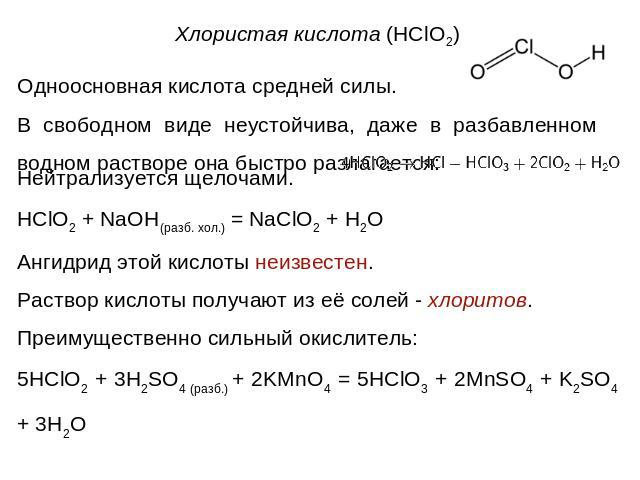
Одноосновная кислота средней силы. В свободном виде неустойчива, даже в разбавленном водном растворе она быстро разлагается:Нейтрализуется щелочами.HClO2 + NaOH(разб. хол.) = NaClO2 + H2OАнгидрид этой кислоты неизвестен.Раствор кислоты получают из её солей - хлоритов.Преимущественно сильный окислитель:5HClO2 + 3H2SO4 (разб.) + 2KMnO4 = 5HClO3 + 2MnSO4 + K2SO4 + 3H2O
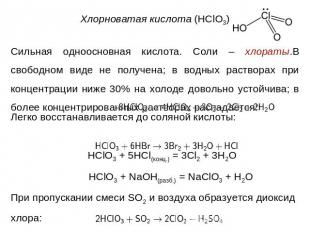
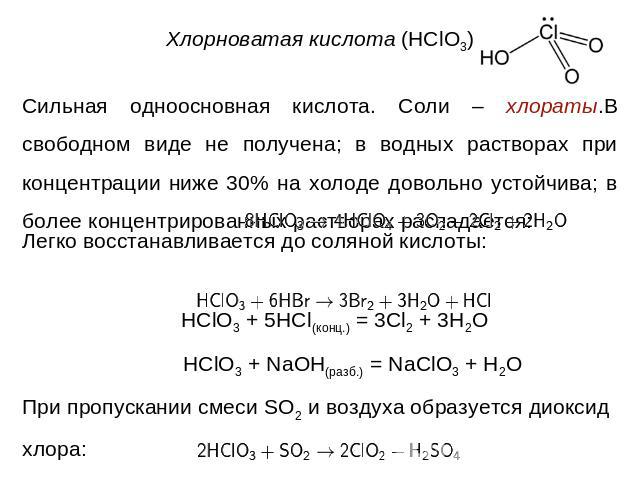
Сильная одноосновная кислота. Соли – хлораты.В свободном виде не получена; в водных растворах при концентрации ниже 30% на холоде довольно устойчива; в более концентрированных растворах распадается: Легко восстанавливается до соляной кислоты: HClO3 + 5HCl(конц.) = 3Cl2 + 3H2O HClO3 + NaOH(разб.) = NaClO3 + H2OПри пропускании смеси SO2 и воздуха образуется диоксид хлора:

Химические методы получения хлора малоэффективны и затратны. На сегодняшний день имеют в основном историческое значение:Метод ШеелеПервоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой:

Метод ДиконаМетод получения хлора каталитическим окислением хлороводорода кислородом воздуха. Электрохимические методыСегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли, основные процессы которого можно представить суммарной формулой:

Самые большие запасы хлора содержатся в составе солей вод морей и океанов
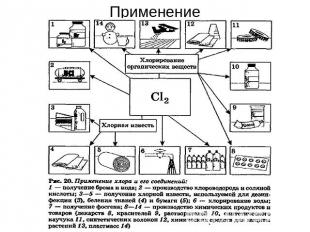
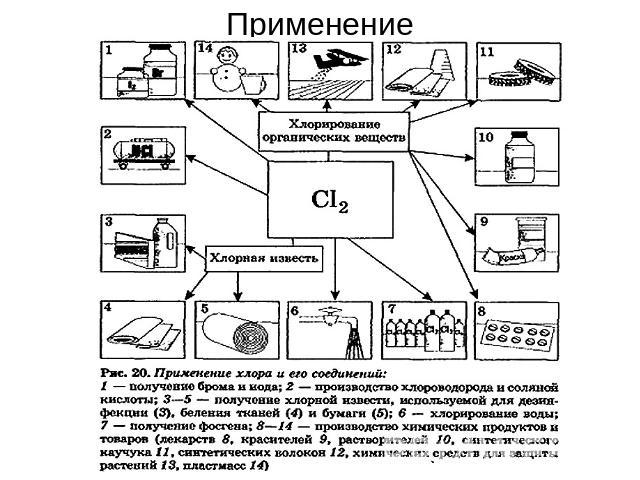
Применение

Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (т.е. в два раза выше порога восприятия запаха хлора).ПДК хлора в атмосферном воздухе следующие: среднесуточная — 0,03 мг/м³; максимально разовая — 0,1 мг/м³.При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3.

Бром и его пары сильно токсичны. Уже при содержании брома в воздухе в концентрации около 0,001 % (по объёму) наблюдается раздражение слизистых оболочек, головокружение, носовые кровотечения, а при более высоких концентрациях — спазмы дыхательных путей, удушье. ПДК паров брома 0,5 мг/м³. Летальня доза для человека перорально составляет 14 мг/кг. При отравлении парами брома пострадавшего нужно немедленно вывести на свежий воздух. Для восстановления дыхания можно на небольшое время пользоваться тампоном, смоченным нашатырным спиртом, на короткое время периодически поднося его к носу пострадавшего. Рекомендуется обильное питьё теплого молока с минеральной водой или содой, кофе. Жидкий бром при попадании на кожу вызывает болезненные и долго не заживающие ожоги.
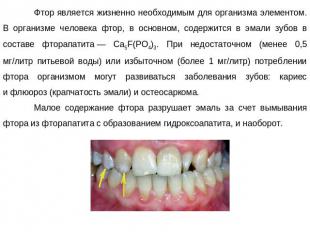
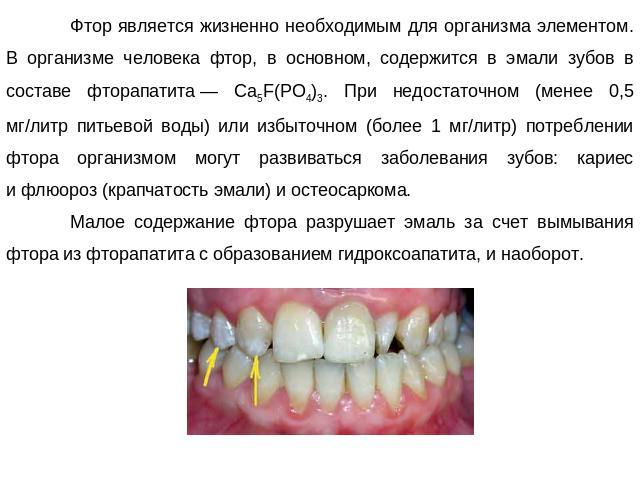
Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес и флюороз (крапчатость эмали) и остеосаркома.Малое содержание фтора разрушает эмаль за счет вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.

Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова) или употреблять фторированную воду (до концентрации 1 мг/л), или применять местные аппликации 1-2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30-50% .Предельно допустимая концентрация связанного фтора в воздухе промышленных помещениях равна 0,0005 мг/литр воздуха.Астат. Будучи схожим по химическим свойствам с иодом, астат радиотоксичен. При попадании в организм концентрируется в печени. Как и иод, астат способен накапливаться в щитовидной железе. Альфа-излучение астата поражает близлежащие ткани, приводит к нарушению их функции и в перспективе — к образованию опухолей. Кроме того, частичное накопление астата наблюдается в молочных железах.













![Химические свойства1. Реакция дисмутации («хлорная вода»)1 стадия: Cl2 + H2O = HCl + HOCl2 стадия: HOCl = HCl + [О] – атомарный кислород2. Окисление простых веществa) с водородом:Cl2 + H2 = 2HClб) с металлами:Cl2 + 2Na = 2NaClв) с некоторыми менее э… Химические свойства1. Реакция дисмутации («хлорная вода»)1 стадия: Cl2 + H2O = HCl + HOCl2 стадия: HOCl = HCl + [О] – атомарный кислород2. Окисление простых веществa) с водородом:Cl2 + H2 = 2HClб) с металлами:Cl2 + 2Na = 2NaClв) с некоторыми менее э…](/images/8/26148/640/img15.jpg)



![Как окислитель реагирует:Mg + 2 HCl → MgCl2 + H2↑Конц. соляная кислота реагирует с медью:2 Cu + 4 HCl → 2 H[CuCl2] + H2↑FeO + 2 HCl → FeCl2 + H2OПри действии сильных окислителей или при электролизе хлороводород проявляет восстановительные свойства:M… Как окислитель реагирует:Mg + 2 HCl → MgCl2 + H2↑Конц. соляная кислота реагирует с медью:2 Cu + 4 HCl → 2 H[CuCl2] + H2↑FeO + 2 HCl → FeCl2 + H2OПри действии сильных окислителей или при электролизе хлороводород проявляет восстановительные свойства:M…](/images/8/26148/640/img19.jpg)
![Смесь 3v HCl : 1v HNO3 называется «царской водкой». Она способна растворять даже золото и платину. 4 H3O+ + 3 Cl− + NO3− = NOCl + Cl2 + 6 H2OРасстворение идет благодаря высокой концентрации хлорид-ионов :3 Pt + 4 HNO3 + 18 HCl → 3 H2[PtCl6] + 4 NO↑ … Смесь 3v HCl : 1v HNO3 называется «царской водкой». Она способна растворять даже золото и платину. 4 H3O+ + 3 Cl− + NO3− = NOCl + Cl2 + 6 H2OРасстворение идет благодаря высокой концентрации хлорид-ионов :3 Pt + 4 HNO3 + 18 HCl → 3 H2[PtCl6] + 4 NO↑ …](/images/8/26148/640/img20.jpg)