Презентация на тему: Алюминий

Восстанавливает металлы из их оксидов (алюмотермия): 8Al + 3Fe3O4 = 4Al2O3 + 9Fe 2Al + Cr2O3 = Al2O3 + 2Cr Химические свойства алюминия

! В природе алюминий встречается только в соединениях . Нахождение алюминия в природе ! По распространенности в литосфере алюминий занимает среди металлов I место - 8,8%, это третье место среди химических элементов после кислорода и кремния
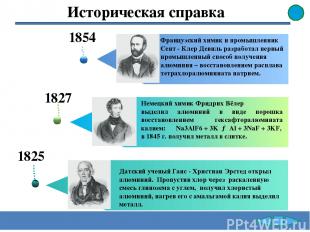
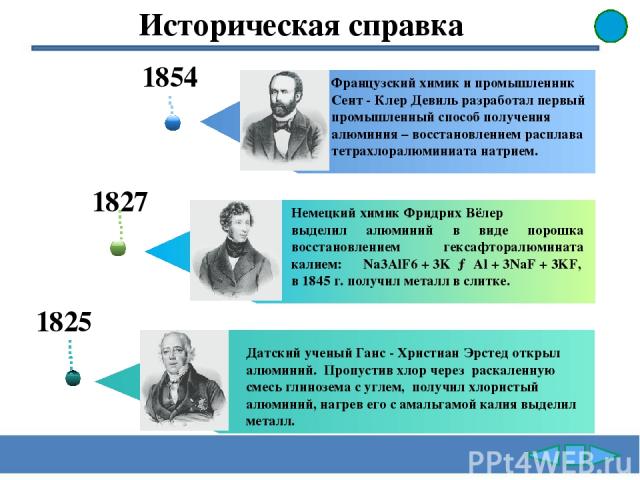
1825 Французский химик и промышленник Сент - Клер Девиль разработал первый промышленный способ получения алюминия – восстановлением расплава тетрахлоралюминиата натрием. 1827 Немецкий химик Фридрих Вёлер выделил алюминий в виде порошка восстановлением гексафторалюмината калием: Na3AlF6 + 3K → Al + 3NaF + 3KF, в 1845 г. получил металл в слитке. 1854 Датский ученый Ганс - Христиан Эрстед открыл алюминий. Пропустив хлор через раскаленную смесь глинозема с углем, получил хлористый алюминий, нагрев его с амальгамой калия выделил металл. Историческая справка

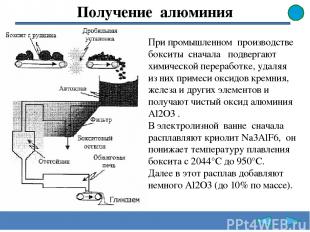
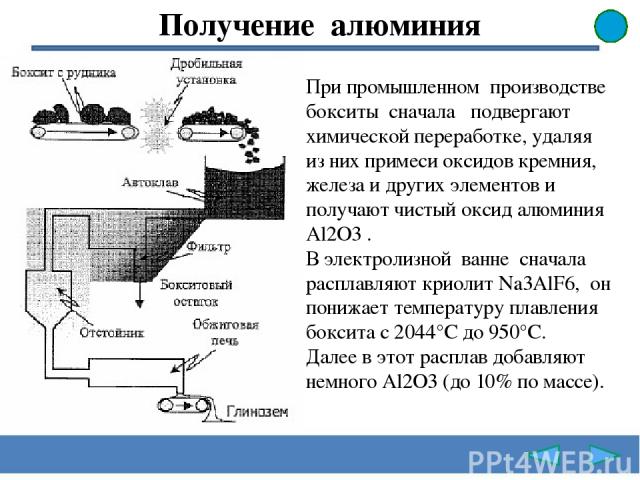
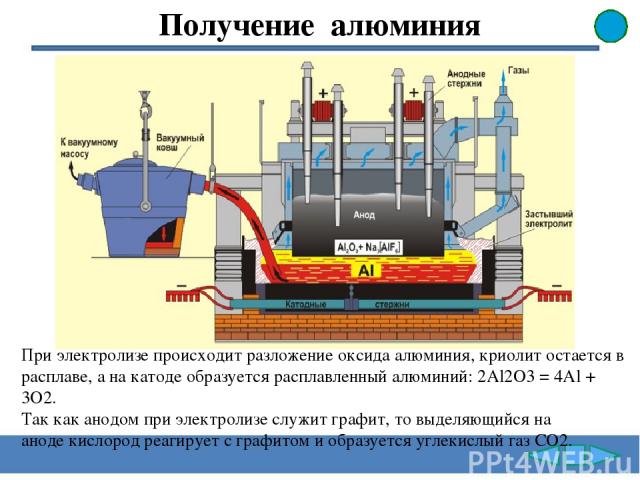
Получение алюминия При промышленном производстве бокситы сначала подвергают химической переработке, удаляя из них примеси оксидов кремния, железа и других элементов и получают чистый оксид алюминия Al2O3 . В электролизной ванне сначала расплавляют криолит Na3AlF6, он понижает температуру плавления боксита с 2044°C до 950°C. Далее в этот расплав добавляют немного Al2О3 (до 10% по массе).

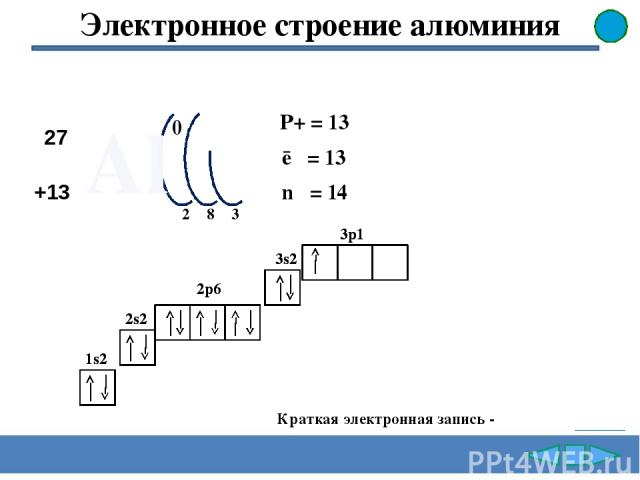
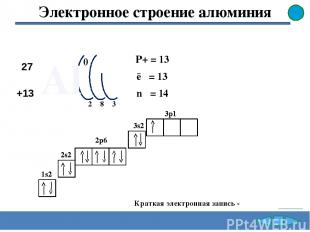
Алюминий - элемент III периода, III группы, главной подгруппы. Заряд ядра атома алюминия равен +13. В ядре атома алюминия 13 протонов, 14 нейтронов. В атоме алюминия 13 электронов. Электронное строение алюминия . На внешнем уровне в атоме 3 электронов. Степень окисления атома алюминия равна +3 . Простое вещество алюминия является металлом. Формула оксида алюминия Al2O3 , его характер амфотерный . Формула гидроксида алюминия Al(OH)3, его характер амфотерный . Общая характеристика алюминия Поставьте пропущенные слова 1s2 2s2 3s2 3p1 2p6
Боксит Бокситы (от названия местности Ле-Бо, Lex Baux, на юге Франции, где впервые обнаружены их залежи) — алюминиевая руда, состоящая в основном из гидроокислов алюминия, окислов и гидроокислов железа и глинистых минералов. Цвет бокситов зависит от содержания железа обычно красный различных оттенков или серый.

Используемые источники О.С.Габриелян «Химия-9», М, Дрофа, стр 3, 57-62; М.Фримантл «Химия в действии», 2 часть, М,, Мир, 1991 г, стр191-192; Н.В.Манцевич «Неорганическая химия в таблицах», Минск, Современная школа, 2008г, стр . 364-372; Видеофрагменты из CD «Химия для всех XXI. Химические опыты со взрывами и без» 1С –Образовательная коллекция; http://ru.wikipedia.org/wiki/ http://www.catalogmineralov.ru/1.html http://www.aluminiumleader.com/ http://webelements.narod.ru/elements/Al.htm http://www.uchmarket.ru/n_2237_9.htm http://archive.businesskomi.ru/rk/branches/4887/ http://www.mtodelta.ru/?id=histal1

Название cапфира происходит от греческого "sappheiros" - "синий камень". Несмотря на то, что в названии заложен только один из многочисленных оттенков, цветовая гамма сапфиров поражает своим разнообразием: пурпурно-голубой, зеленый, желтый, бесцветный, оранжевый и розово-оранжевый. Минерал: голубая или синяя разновидность корунда. Сапфир

Нефелин Нефелин (элеолит) — породообразующий минерал, алюмосиликат калия и натрия ортокремниевой кислоты (Na,K)AlSiO4. Используют в производстве алюминия, соды, в стекольной, кожевенной промышленности. В больших количествах получается в качестве отхода при добыче апатита.

Название гранат произошло от латинского Granatus, так назывались зернышки гранатового дерева. Минерал густо-красного цвета, цвета "чистого пламени", и высокой твердости. Химическое название граната - алюмосиликат магния-железа-марганца(Mg,Fe,Mn)3Al2(SiO4)3. Гранат

Свое название рубин получил от латинского rubeus или красный. Древние русские названия камня - яхонт и карбункул. Окраска варьируется от глубокого розового цвета до густо красного с фиолетовым оттенком. Минерал: диоксид алюминия. Относится к группе корундов, и занимает по твердости второе место, уступающее в этом отношении лишь алмазу. Рубин

Название берилла от древнегреческого «Berullos» означает «кристалл». Разновидности: золотисто- желтый (золотой берилл), розовый (морганит), голубой (аквамарин), красный (биксбит), бесцветный (гошенит), зеленый (изумруд). Химический состав: ВеО - 14,1%, Аl2О3 - 19%; SiО2 - 66,9%; отмечаются примеси Na, K, Li, Cs, Rb, Fe, V, Cr. Берилл

Назван по острову Топазион (ныне Зебергед) в Красном море. Цвет топаза разнообразный, чаще встречаются прозрачные бесцветные и бледно-голубые топазы, на мировом рынке больше всего ценятся фиолетовые. Топаз - очень твердый (режет стекло). Химическая формула: Al2(OH, F)2SiO4 Топаз

Название дано за сияющие голубые переливы. Минерал образует прозрачные кристаллы с голубовато-белым, "лунным" мерцанием поверхности. Встречаются кристаллы и светло-желтого цвета. Химическая формула: К(АlSi3О8) Лунный камень

Название от французского spinelle уменьшительной формы латинского слова spina (шип). Чистая шпинель бесцветна, но в природе такие камни встречаются очень редко. Различают оттенки синего и красного цвета шпинели, она бывает зеленоватой и коричневатой. Шпинель является сложным окислом магния и алюминия MgAl2O4. Благородный шпицель

Легко реагирует с простыми веществами: С кислородом: 4Al + 3O2 = 2Al2O3 С галогенами: 2Al + 3J2 = 2AlJ3 С другими неметаллами реагирует при нагревании: 2Al + 3S = Al2S3 2Al + N2 = 2AlN 4Al + 3С = Al4С3 Химические свойства алюминия Реакция алюминия с иодом

Название «лазурит» произошло от персидского слова lazurite - синий. Темно-синий с вкраплениями золотистого пирита, создающего впечатление звезд на синем небе. Яркий и сверкающий на солнечном свету лазурит становится темным и мрачным при свечах и электрическом освещении. Лазурит - довольно мягкий и хрупкий минерал, легко обрабатывается и полируется. Химическая формула: 6Nа(АlSiO4)Na2S. Лазурит

Алюминий Содержание

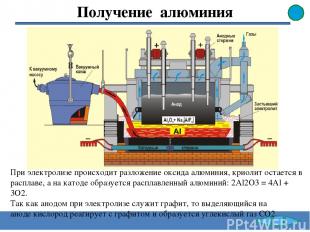
Получение алюминия При электролизе происходит разложение оксида алюминия, криолит остается в расплаве, а на катоде образуется расплавленный алюминий: 2Al2О3 = 4Al + 3О2. Так как анодом при электролизе служит графит, то выделяющийся на аноде кислород реагирует с графитом и образуется углекислый газ СО2.
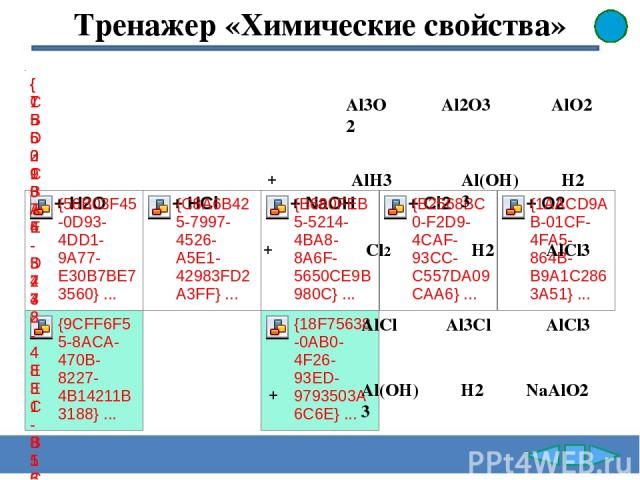
+ + + Al3О2 AlO2 Al(ОН) 3 AlCl3 Al3Cl AlCl3 AlH3 Cl2 AlCl Al(OH) 3 Al2O3 H2 H2 H2 NaAlO2 Тренажер «Химические свойства»

Спасибо за урок! Благодарю за сотрудничество.