Презентация на тему: Алюминий

Алюминий Al

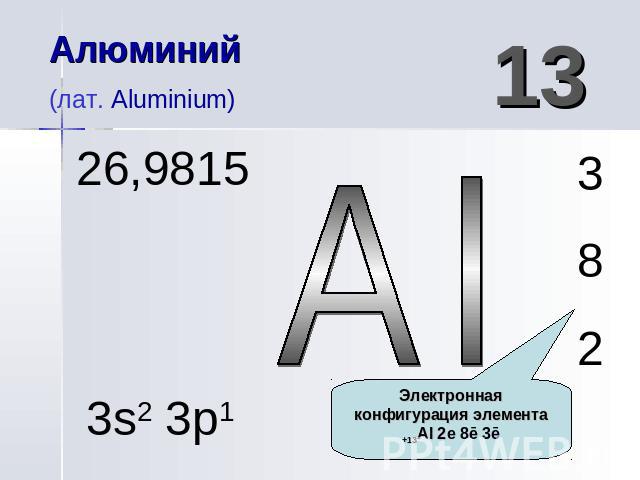
Алюминий (лат. Aluminium) 26,9815 13 Al 3s2 3p1

Алюминий (лат. Aluminium) Был впервые получен датским физиком Х.К. Эрстедом в 1825 г. Название этого элемента происходит от латинского алюмен, так в древности назывались квасцы, которые использовали для крашения тканей. Латинское название, вероятно, восходит к греческому «халмэ» - рассол, соляной раствор.

Алюминий(лат. Aluminium) Порядковый номер. Химический элемент III группы главной подгруппы 3-го периода.

Алюминий (лат. Aluminium) 26,9815 Атомная масса элемента
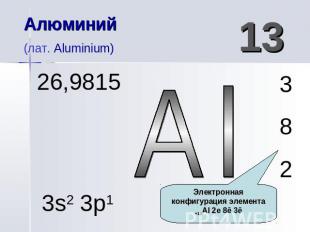
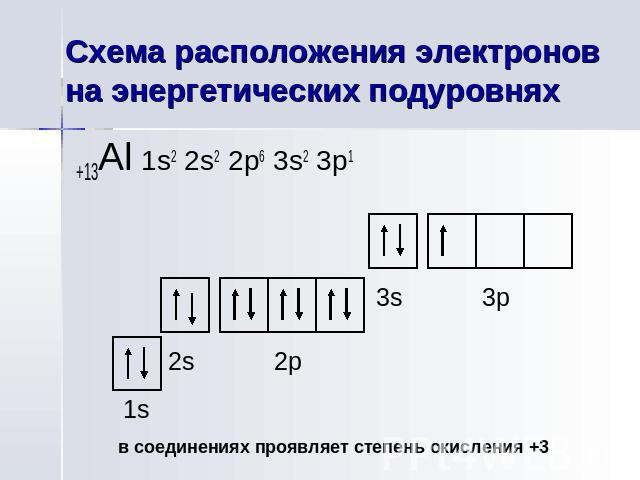
Алюминий(лат. Aluminium) Электронная конфигурация элемента +13Al 2е 8ē 3ē
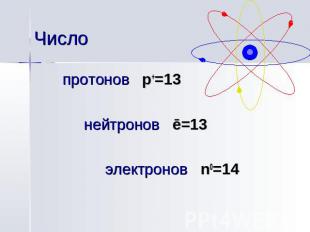
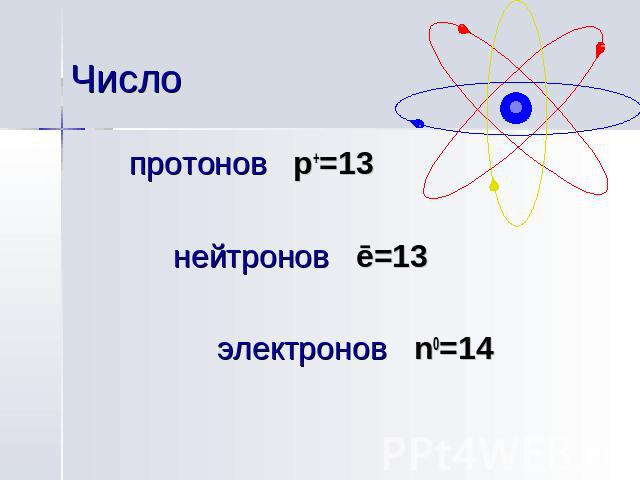
Число протонов p+=13 нейтронов ē=13 электронов n0=14

Изотопы алюминия В природе представлен лишь один стабильный изотоп 27Al. Искусственно получен ряд радиоактивных изотопов алюминия, наиболее долгоживущий 26Al имеет период полураспада 720 тысяч лет.
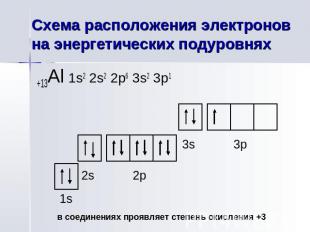
Схема расположения электронов на энергетических подуровнях

Главные квантовые числа Главное квантовое число n=3 Орбитальное квантовое число l=1 Магнитное квантовое число ml=-1 Спиновое квантовое число ms=+½

Al – типичный металл Схема образования вещества Al 0- 3ē Al+3 Тип химической связи -металлическая Тип кристаллической решетки – кубическая гранецентрированная

Физические свойства вещества Al – серебристо-белый металл, пластичный, легкий, хорошо проводит тепло и электрический ток, обладает хорошей ковкостью, легко поддаётся обработке, образует лёгкие и прочные сплавы. =2,7 г/см3 tпл.=6600С

Химические свойства вещества Al активный металл восстанавливает все элементы, находящиеся справа от него в электрохимическом ряду напряжения металлов, простые вещества – неметаллы. Из сложных соединений алюминий восстанавливает ионы водорода и ионы менее активных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта защитной оксидной плёнкой Al2 O3

Алюминий реагирует: 1. 2Al+3O2 = 2Al2O3 + O – покрывается пленкой оксида, но в мелкораздроблен-ном виде горит с выделением большого количества теплоты. 2. 2Al + 3Cl2 = 2 AlCl3 (Br2, I3) – на холоду 3. 2Al + 3S = Al2S3 - при нагревании 4. 4Al + 3С = Al4С3 - при нагревании 5. Алюминотермия – получение металлов: Fe, Cr, Mn, Ti, W и другие, например: 3Al + 3Fe3O4 = 4Al2O3 + 9Fe

Получение вещества Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6), электролизом расплава AlCl3 (расходуется около 16 кВт·час на 1 кг Al) Электролиз: Al2O3 при 9500С в расплаве криолита: На катоде: Al3+ + 3e = Al0 На угольном аноде (расходуется в процессе электролиза): O2- - 2e = 00; C + O = CO; 2CO + O2 = 2CO2;

Применение Al

Ряд факторов применения алюминия: Алюминий – самый распространенный металл земной коры. Его ресурсы практически неисчерпаемы. Обладает высокой коррозионной стойкостью и практически не нуждается в специальной защите. Высокая химическая активность алюминия используется в алюминотермии. Малая плотность в сочетании с высокой прочностью и пластичностью его сплавов делает алюминий незаменимым конструкционным материалом в самолетостроений и способствует расширению его применения в наземном и водном транспорте, а также в строительстве. Относительно высокая электропроводность позволяет заменять им значительно более дорогую медь в электротехнике.

Оксид алюминия Al2О3: Очень твердый (корунд, рубин) порошок белого цвета, тугоплавкий - 20500С. Не растворяется в воде. Амфотерный оксид, взаимодействует: а) с кислотами Al2O3 + 6H+ = 2Al3+ + 3H2O б) со щелочами Al2O3 + 2OH- = 2AlO-2 + H2O Образуется: а) при окислении или горении алюминия на воздухе 4Al + 3O2 = 2Al2O3 б) в реакции алюминотермии 2Al + Fe2O3 = Al2O3 + 2Fe в) при термическом разложении гидроксида алюминия 2Al (OH)3 = Al2O3 + 3H2O

Гидроксид алюминия Al(ОН)3: Белый нерастворимый в воде порошок. Проявляет амфотерные свойства, взаимодействует: а) с кислотами Al (OH)3 + 3HCl = AlCl3 + 3H2O б) со щелочами Al (OH)3 + Na OH = NaAlO2 + 2H2O Разлагается при нагревании 2Al (OH)3 = Al2O3 + 3H2O Образуется: а) при взаимодействии растворов солей алюминия с растворами щелочей (без избытка) Al3+ + 3OH- = Al (OH)3 б) при взаимодействии алюминатов с кислотами (без избытка) AlO-2 + H+ + H2O = Al (OH)3

Влияние соединений алюминия на загрязнение окружающей среды. Почти все загрязняющие вещества, которые первоначально попали в атмосферу, в конечном итоге оказываются на поверхности суши и воды. Оседающие аэрозоли могут содержать ядовитые тяжелые металлы – свинец, кадмий, ртуть, медь, ванадий, кобальт, никель. Обычно они малоподвижны и накапливаются в почве. Но в почву попадают с дождями также кислоты. Соединяясь с ними, металлы могут переходить в растворимые соединения, доступные растениям. В растворимые формы переходят также вещества, постоянно присутствующие в почвах, что иногда приводит к гибели растений. Примером может служить весьма распространенный в почвах алюминий, растворимые соединения которого поглощаются корнями деревьев. Алюминиевая болезнь, при которой нарушается структура тканей растений, оказывается для деревьев смертельной.

Металл будущего Вывод: Обладая такими свойствами как лёгкость, прочность, коррозионноустойчивость, устойчивость к действию сильных химических реагентов - алюминий нашёл большое значение в авиационном и космическом транспорте, применение во многих отраслях народного хозяйства. Особое место занял алюминий и его сплавы в электротехнике, а за ними будущее нашей науки и техники.