Презентация на тему: Алюминий и его соединения

Алюминийи его соединения

Учителя химии: Гершановская Евгения ВладимировнаГБОУ СОШ № 880Город МоскваПопова Светлана АнатольевнаГБОУ СОШ № 1465Город Москва
СОДЕРЖАНИЕ
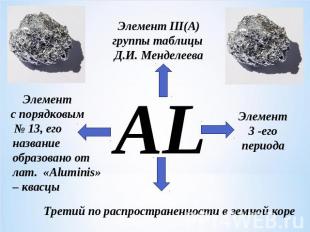
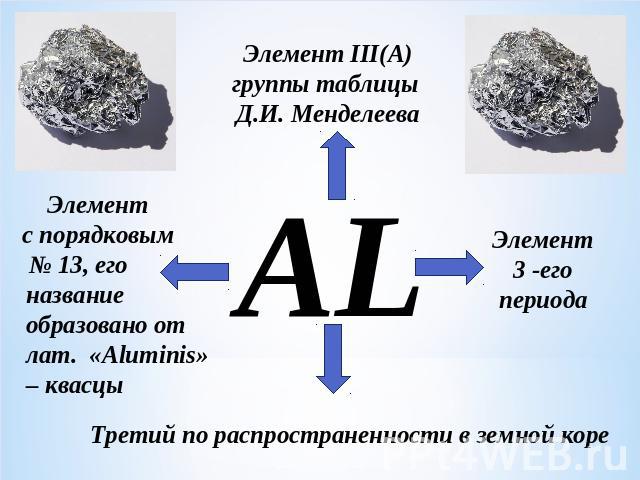
Элемент III(A)группы таблицы Д.И. МенделееваЭлемент с порядковым № 13, его название образовано от лат. «Aluminis» – квасцы

Датский физик Ганс Эрстед(1777-1851) Впервые алюминий был получен им в 1825 году действием амальгамы калия на хлорид алюминия с последующей отгонкой ртути.

Современные метод получения был разработан независимо друг от друга: американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия в расплаве криолита с последующим электролизом с использованием расходуемых коксовых или графитовых электродов.

Холл Чарльз (1863 – 1914) американский инженер-химикБудучи студентом Оберлинского колледжа, он узнал, что можно разбогатеть и получить благодарность человечества,если изобрести способ получения алюминия в промышленных масштабах. Как одержимый, Чарльз проводил экспериментыпо выработке алюминия путем электролиза криолитно-глиноземногорасплава. 23 февраля 1886 года спустя годпосле окончания колледжа Чарльз получил с помощью электролиза первый алюминий.

Поль Эру (1863-1914) –французский инженер - химикВ 1889 году открыл алюминиевый завод во Фроне (Франция), став его директором, он сконструировал электродуговую печь для выплавки стали, названную его именем; он разработал также электролитический способ получения алюминиевых сплавов

Важнейшим на сегодня минералом алюминия является бокситОсновной химический компонент боксита - глинозем (Al2O3) (28 - 80%).

Физические свойства Занимает 1-е место в земной коре среди металловСовокупность этих важных свойств позволяет отнести алюминий к числу важнейших технических материалов

Химические свойства Взаимодействие с простыми веществами:с кислородом, образуя оксид алюминия: 4Al + 3O2 = 2Al2O3с серой, образуя сульфид алюминия: 2Al + 3S = Al2S3 с азотом, образуя нитрид алюминия: 2Al + N2 = 2AlN с углеродом, образуя карбид алюминия: 4Al + 3С = Al4С3 с хлором, образуя хлорид алюминия:2Al + 3Cl2 = 2AlCl3

1. с водой (после удаления защитной оксидной пленки) 2Al + 6H2O = 2Al(OH)3 + 3H2 2. с растворами щелочей (с образованием тетрагидроксоалюмината) 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 3. c соляной и разбавленной серной кислотами: 2Al + 6HCl = 2AlCl3 + 3H2 2Al + 3H2SO4(разб) = Al2(SO4)3 + 3H2 4. с оксидами менее активных металлов (алюминотермия) 8Al + 3Fe3O4 = 4Al2O3 + 9Fe 2Al + Cr2O3 = Al2O3 + 2Cr

В АвиацииВ Космической техникеВ ЭлектротехникеВ СудостроенииВ СтроительствеВ АвтотранспортеВ бытуЛегкий сплав дюраль используетсяв различных областях

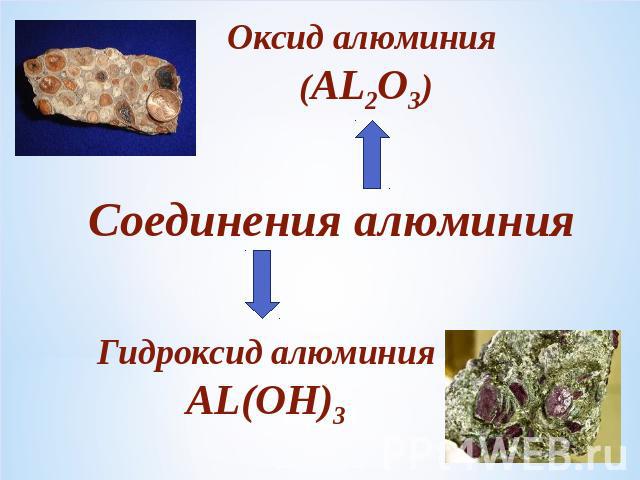
Оксид алюминия (AL2O3)Соединения алюминияГидроксид алюминияAL(OH)3
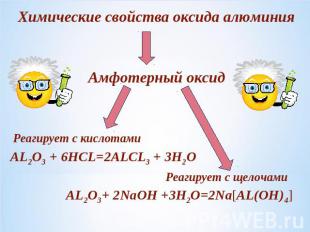
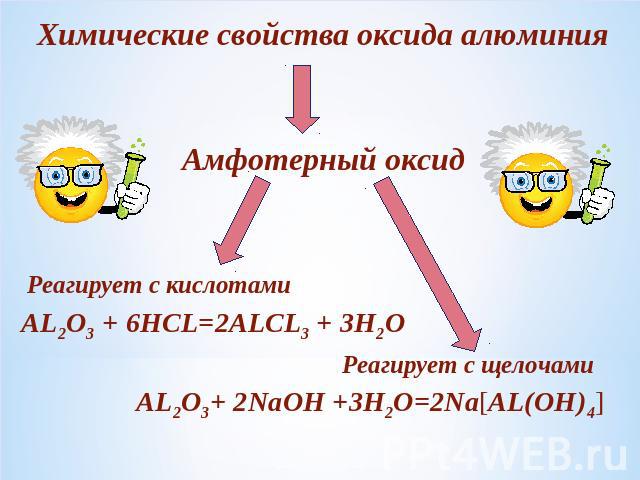
Химические свойства оксида алюминияАмфотерный оксидРеагирует с кислотамиРеагирует с щелочами
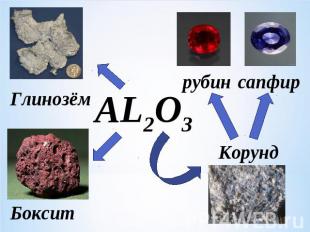
ГлинозёмрубинсапфирБоксит
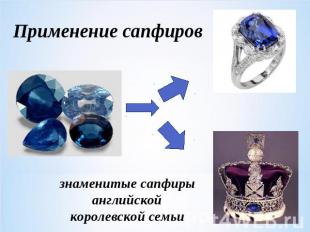
Применение сапфировзнаменитые сапфиры английской королевской семьи

Применение рубинов
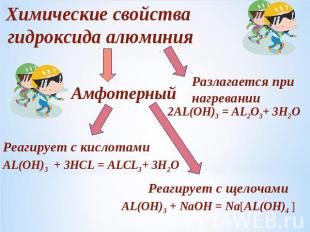
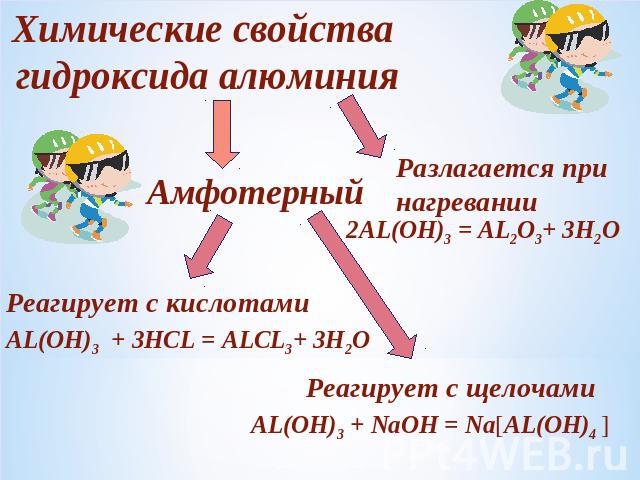
Химические свойства гидроксида алюминияАмфотерныйРазлагается при нагреванииРеагирует с кислотами
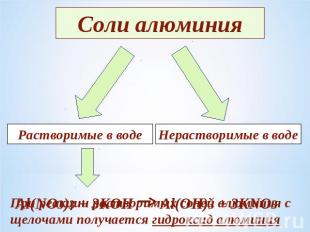
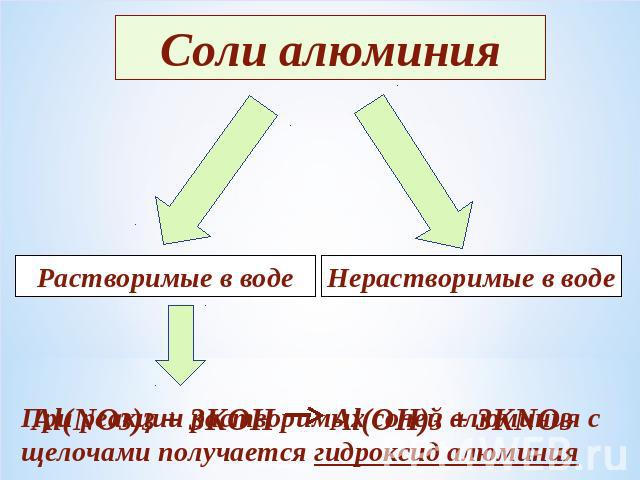
Соли алюминияРастворимые в водеНерастворимые в водеAl(NO3)3 + 3KOH Al(OH)3 + 3KNO3

Проверьте себя:Вставьте пропущенные слова в текст:Алюминий – это металл, у которого в соединениях степень окисления равна . В природе он встречается в виде .Алюминий может вступать в реакцию с , образуя гидроксид алюминия, который обладает . Алюминий вступает в реакцию для восстановления менее активных металлов из их оксидов

Какие из соединений вступят в реакцию с алюминием:

Ссылки на источники информации и изображений:










![1. с водой (после удаления защитной оксидной пленки) 2Al + 6H2O = 2Al(OH)3 + 3H2 2. с растворами щелочей (с образованием тетрагидроксоалюмината) 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 3. c соляной и разбавленной серной кислотами: 2Al + 6HCl = 2AlCl… 1. с водой (после удаления защитной оксидной пленки) 2Al + 6H2O = 2Al(OH)3 + 3H2 2. с растворами щелочей (с образованием тетрагидроксоалюмината) 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2 3. c соляной и разбавленной серной кислотами: 2Al + 6HCl = 2AlCl…](/images/8/30615/640/img11.jpg)