Презентация на тему: Алюминий (11 класс)

алюминийРаботу выполнили ученики 11 классаСадыков Данила и Розанов ИгорьГБОУ СОШ № 880Город МоскваРуководитель: Учитель химии - Гершановская Евгения Владимировна

Алюминий ( от лат. Aluminium )- химический элемент третьей группы главной подгруппы и третьего периода периодической системы Д.И.Менделеева

Алюминий – это серебристо-белый металл, его плотность – 2,7 г/ см3, tпл = 660 0C, tкип = 2350 0CАлюминий обладает высокой электропроводностью, теплопроводностью, высокой отражающей способностью

Х И М И Ч Е С К И Е С В О Й С Т В А А Л Ю М И Н И Я
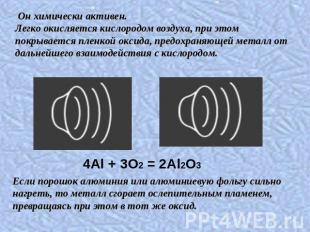
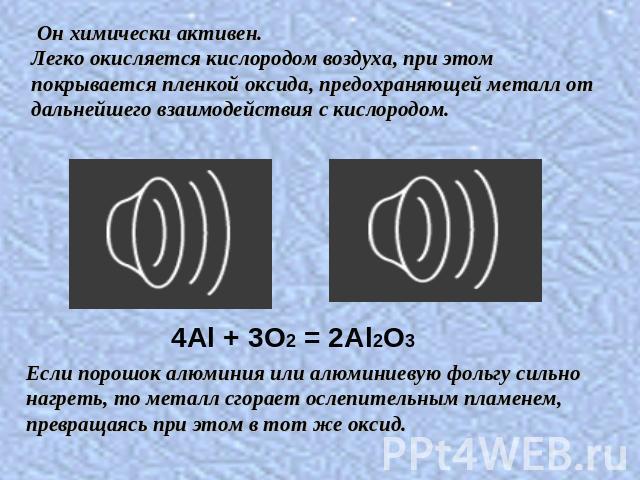
Он химически активен. Легко окисляется кислородом воздуха, при этом покрывается пленкой оксида, предохраняющей металл от дальнейшего взаимодействия с кислородом.Если порошок алюминия или алюминиевую фольгу сильно нагреть, то металл сгорает ослепительным пламенем, превращаясь при этом в тот же оксид.
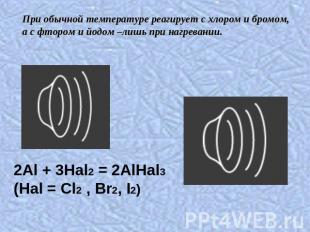
При обычной температуре реагирует с хлором и бромом, а с фтором и йодом –лишь при нагревании.

Без оксидной пленки алюминий активно взаимодействует с неметаллами:

Алюминий растворяется в соляной и серной кислотах, а также в водных растворах щелочей

Алюминий является сильным восстановителем других металлов из их оксидов (алюминотермия):Алюминий без оксидной пленки активно взаимодействует с водой:

Применение алюминия Большая часть производимого алюминия идет для получения легких сплавов. Дюраль (легкий сплав) по прочности на разрыв близок к стали, но почти в 3 раза легче её. Его используют в авиации и космической техникеВ чистом виде алюминий находит применение из-за своей мягкости: из него изготавливают прокладки для герметизации различных приборов, провода, т. к.этот металл третий по электропроводности.

Сплавы алюминия используют в строительстве, т. к. из них легко изготовить различные профили балок и разные конструкции.
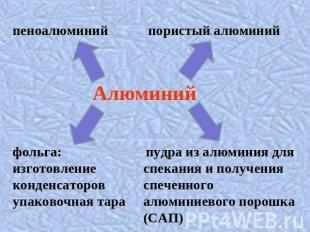
фольга:изготовление конденсаторовупаковочная тара пудра из алюминия для спекания и получения спеченного алюминиевого порошка (САП)

Алюминий очень технологичный металл: его можно обрабатывать давлением при нормальных и чуть повышенных температурах. Изделия из него можно готовить методами прокатки, вытягивания, штамповки, ковки, прессовки

В чистом виде его впервые получил датский физик Х. Эрстед в 1825 г. Немецкий химик Ф.Вёлер получил металлический алюминий в слитке. В 1854 г. француз А. Сент- Клер Девиль получил его посредством электролиза.
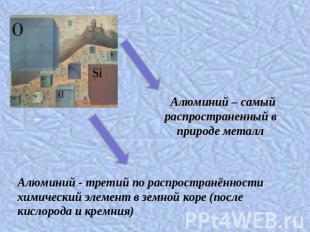
Алюминий – самый распространенный в природе металлАлюминий - третий по распространённости химический элемент в земной коре (после кислорода и кремния)

Корунд

Уральский корунд

Прозрачные кристаллы корунда, окрашенные примесями в красный цвет называют рубином, а всиний цвет называют сапфиром

Рубины и сапфиры в наше время получают искусственным путем в промышленных масштабах

Впервые получен восстановлением хлорида алюминия металлическим калием или натрием без доступа воздуха: AlCl3 + 3Na = Al + 3NaCl. В промышленности – электролиз раствора глинозема Al2O3 в расплаве криолита Na3AlF6 с добавкой CaF2. криолит используется как растворитель оксида алюминия, а добавка фторида кальция позволяет поддерживать температуру плавления в электролитической ванне не выше 1000 0С.

Гель из гидроксида алюминия входит в состав лекарств для лечения болезней желудка. Гидроксид алюминия используется для очистки воды, т. к. обладает способностью поглощать различные вещества. Оксид алюминия в виде корунда используется как абразивный материал для обработки металлических изделий. Оксид алюминия в виде рубина широко используется в лазерной технике. Оксид алюминия применяется в качестве катализатора, для разделения веществ в хроматографии.

Ссылки на источники информации и изображений: