Презентация на тему: Характеристика щелочных металлов

Характеристика щелочных металлов 9 класс

Уберите лишнее Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании. Металлы обладают электропроводностью и теплопроводностью. Для металлов характерна металлическая кристаллическая решетка. У атомов металлов на внешнем уровне 1-3 электрона. У атомов металлов на внешнем уровне 1-3 электрона. Металлы являются восстановителями и окислителями. Для металлов характерна металлическая кристаллическая решетка. Металлы обладают электропроводностью и теплопроводностью. При взаимодействии с кислородом металлы принимают электроны. Все металлы активно взаимодействуют с кислотами. Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании. Мg, Be относятся к щелочноземельным металлам.
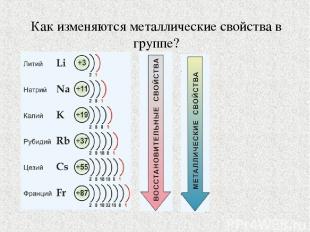
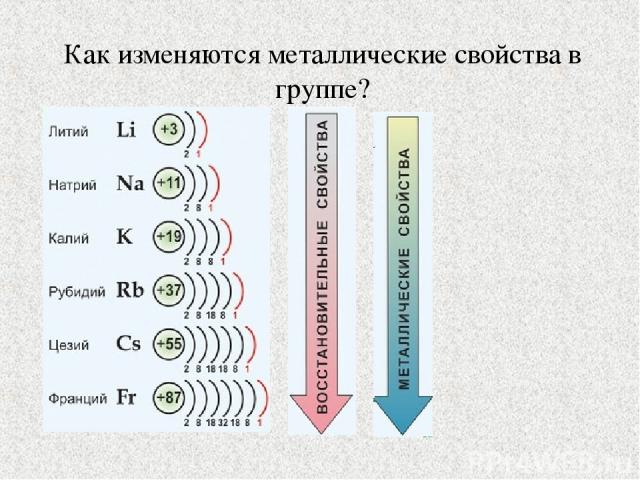
Как изменяются металлические свойства в группе?

Радиусы атомов элементов 1А группы
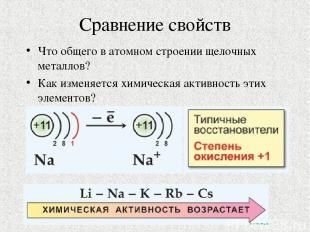
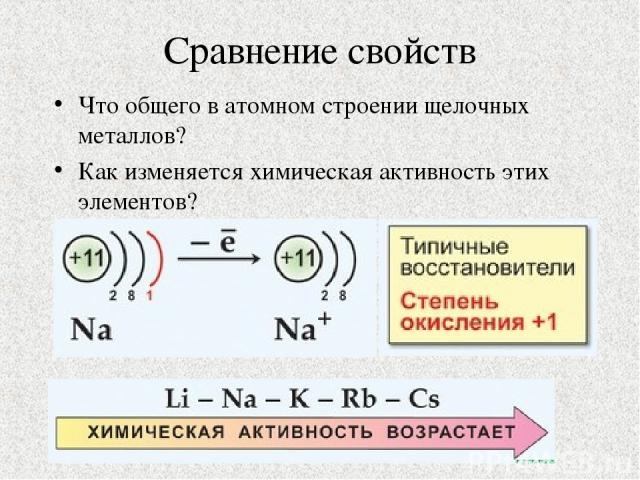
Сравнение свойств Что общего в атомном строении щелочных металлов? Как изменяется химическая активность этих элементов?

ИСТОРИЯ ОТКРЫТИЯ Натрий и калий – 1807г. Английский химик и физик Г.Дэви получил их в виде металлов при электролизе расплавленного едкого натра NaOH и едкого кали КОН. Литий открыт в 1817г. шведским химиком И. Арфведсон. Этот минерал выглядит как самый обыкновенный камень, и поэтому металл назвали литием, от греческого «литос» - камень.

Происхождение названий Li (1817) лат. " литос" - камень Na (1807) араб. "натрум" - сода К (1807) араб. "алкали" - щелочь Rb (1861) лат. "рубидус" - темно-красный Cs (1860) лат. "цезиус" - небесно-голубой Fr (1939) от названия страны Франция – его на Земле всего 25 мг.
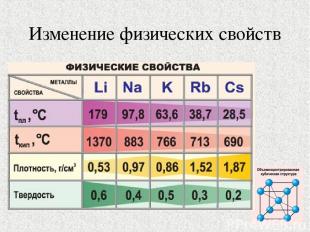
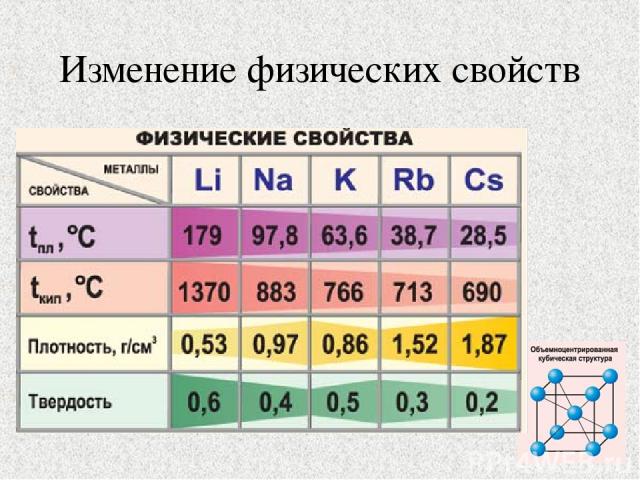
Изменение физических свойств
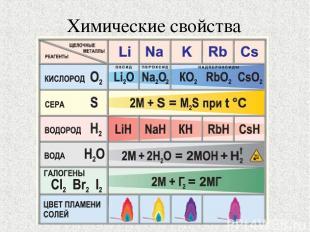
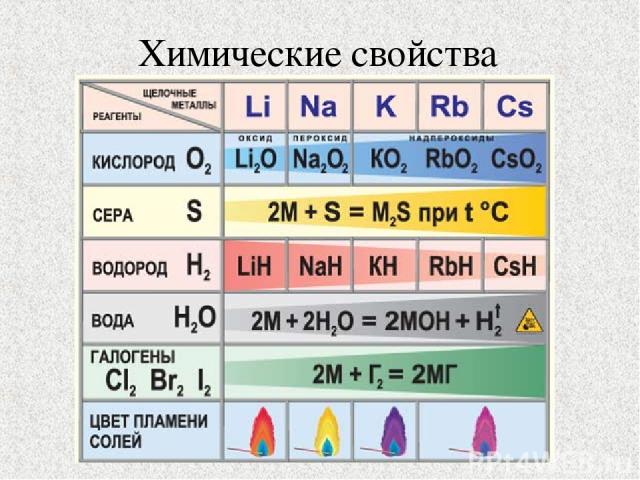
Химические свойства

Оксиды щелочных металлов Оксид лития Оксид натрия Составьте общую формулу оксидов.

Гидроксиды щелочных металлов KOH – гидроксид калия NaOH – гидроксид натрия LiOH – гидроксид лития Какова общая формула гидроксидов?

Нахождение в природе Встречаются ли щелочные металлы в природе в свободном состоянии?


Немного истории Древнегреческий поэт Гомер, назвал поваренную соль «божественной». В те далекие времена она ценилась выше золота. Из-за месторождений соли происходили военные столкновения, а нехватка соли у населения вызывала «соляные бунты». М.В.Ломоносов писал, что в его время за четыре-пять плиток соли можно было купить раба. Многие племена в Центральной Африке отдавали за чашку соли чашку золота. В Китае XIII века из каменной соли делали монеты.

Поваренная соль и география Поваренная соль известна человеку с незапамятных времен, и название ее сходно во многих языках. В честь соли названы многие города, реки и озера: Солигалич, Соликамск, Сольвычегорск, Соль-Илецк, Сольцы, Усолье и Усолье-Сибирское, реки Усолка и Соленая и многие другие.

Поваренная соль в организме человека Соль – обязательная составная часть организма человека. Соль поддерживает нормальную деятельность клеток, из которых состоят все ткани и органы. Из соли в желудке вырабатывается соляная кислота, без которой невозможно переваривание пищи. Суточная потребность в поваренной соли для взрослого человека составляет 10 – 15 грамм.

Применение поваренной соли Производство химических веществ --- соляной кислоты --- гидроксида натрия --- хлора --- соды Для консервирования Приправа к пище Производство мыла

Сколько нужно времени для того, чтобы съесть пуд соли? Есть поговорка: «Чтобы хорошо узнать человека, надо съесть с ним пуд соли». Оказывается это можно сделать всего за год с небольшим. Ведь потребность соли для нормального питания человека составляет не менее 7 килограммов в год.

Карбонат калия - поташ Калийная селитра

Задание На странице 130 учебника найдите ответ на вопрос: чем похожи и чем отличаются кальцинированная, стиральная и питьевая сода? Запишите их формулы.

Проверьте Na2CO3 – кальцинированная сода Na2CO3*10Н2О – кристаллическая или стиральная сода Na2НCO3 – питьевая сода

Тест-проверка Вариант 1. 1-Б, 2-В, 3-В, 4-А,5-А. Вариант 2 1-Б, 2-В, 3-В, 4-Б, 5-А

Домашнее задание 1 уровень: Прочитать параграф 24, Выяснить: Какая связь между подводной лодкой и щелочными металлами №1 – устно, №5 составить уравнения реакций. 2 уровень: + №3 решить задачу. 3 уровень + №4 вспомнить качественные реакции на ион хлора и карбонат-ион

О каком элементе идет речь? Хранят обычно в керосине, и бегает он по воде, В природе, помните, отныне, Свободным нет его нигде, В солях открыть его возможно Желтеет пламя от него И получить из соли можно Как Дэви получил его.