Презентация на тему: Характеристика щелочных металлов

общая характеристика Презентация к уроку химии, 9 класс МОУ СОШ № 104 г. Челябинска студентки 5 курса Шабаевой Е.В. 2009 5klass.net

ПЛАН УРОКА Строение атомов элементов главной подгруппы I группы. Щелочные металлы – простые вещества. Химические свойства щелочных металлов. Соединения щелочных металлов. Природные соединения и применение щелочных металлов и их соединений. История открытия
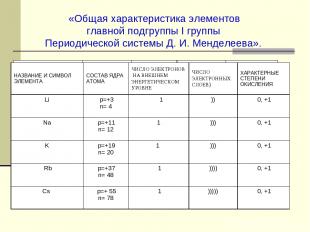
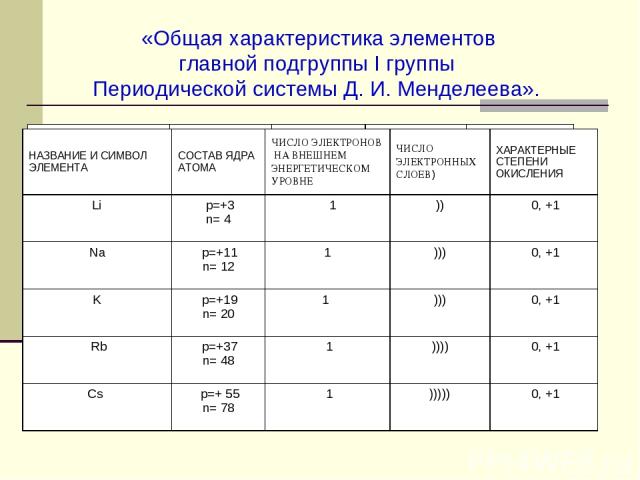
«Общая характеристика элементов главной подгруппы I группы Периодической системы Д. И. Менделеева». НАЗВАНИЕ И СИМВОЛ ЭЛЕМЕНТА СОСТАВ ЯДРА АТОМА ЧИСЛО ВАЛЕНТНЫХ ЭЛЕКТРОНОВ ЧИСЛО ЭЛЕКТРОННЫХ СЛОЕВ ХАРАКТЕРНЫЕ СТЕПЕНИ ОКИСЛЕНИЯ НАЗВАНИЕ И СИМВОЛ ЭЛЕМЕНТА СОСТАВ ЯДРА АТОМА ЧИСЛО ЭЛЕКТРОНОВ НА ВНЕШНЕМ ЭНЕРГЕТИЧЕСКОМ УРОВНЕ ЧИСЛО ЭЛЕКТРОННЫХ СЛОЕВ) ХАРАКТЕРНЫЕ СТЕПЕНИ ОКИСЛЕНИЯ Li p=+3 n= 4 1 )) 0, +1 Na p=+11 n= 12 1 ))) 0, +1 K p=+19 n= 20 1 ))) 0, +1 Rb p=+37 n= 48 1 )))) 0, +1 Cs p=+ 55 n= 78 1 ))))) 0, +1

Закономерности в строении атомов щелочных металлов: - Сходство внешнего электронного слоя. Увеличение числа электронных слоев в атоме. - Радиусы атомов увеличиваются от Li к Cs, следовательно увеличиваются и восстановительные свойства металлов от Li к Cs. Последовательное изменение атомных радиусов.
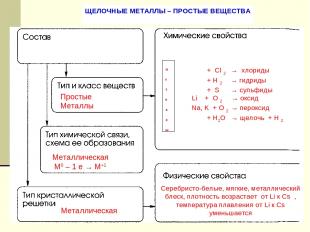
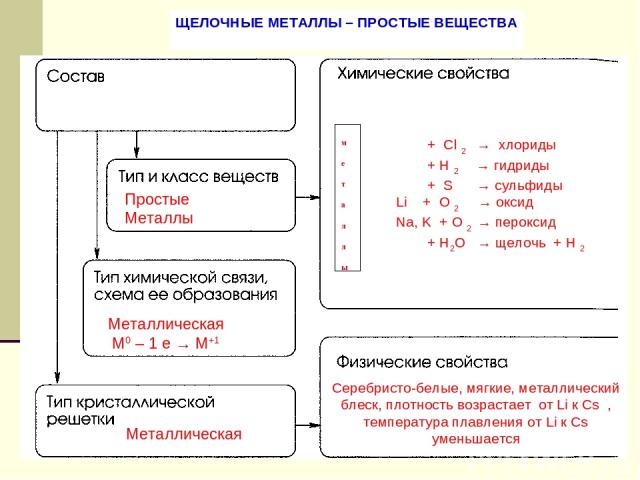
ЩЕЛОЧНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА Простые Металлы Металлическая М0 – 1 е → М+1 Металлическая Серебристо-белые, мягкие, металлический блеск, плотность возрастает от Li к Cs , температура плавления от Li к Cs уменьшается + Cl 2 → хлориды + H 2 → гидриды + S → сульфиды Li + O 2 → оксид Na, K + O 2 → пероксид + H2O → щелочь + Н 2 м е т а л л ы
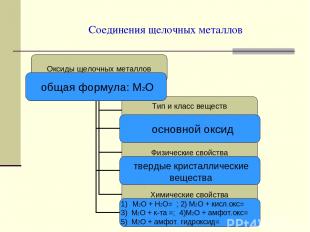
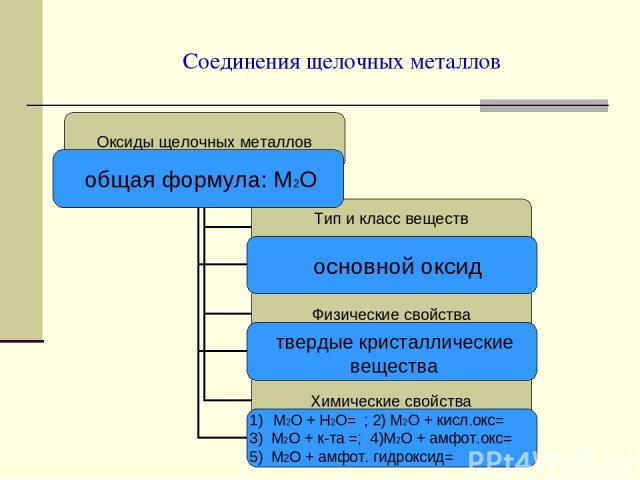
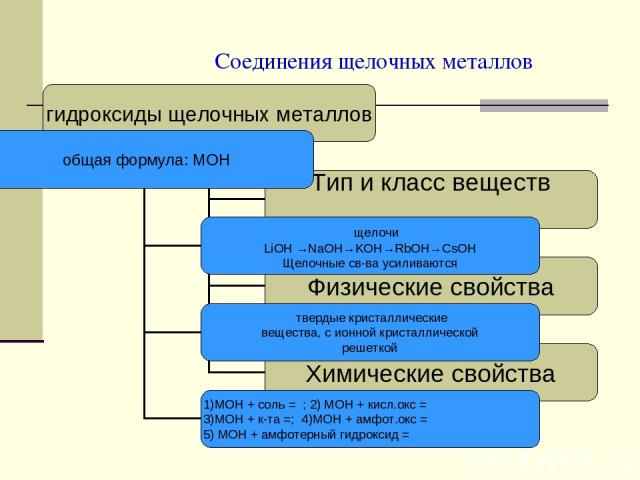
Соединения щелочных металлов
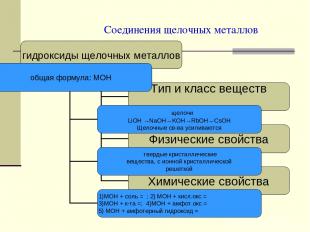
Соединения щелочных металлов
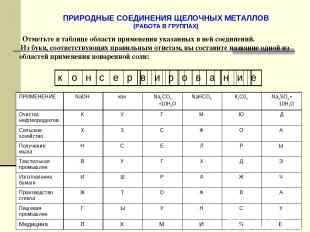
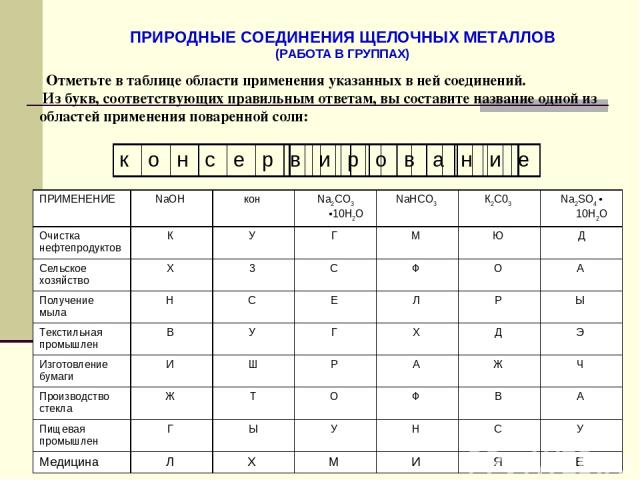
ПРИРОДНЫЕ СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ (РАБОТА В ГРУППАХ) . Заполните таблицу. Отметьте в таблице области применения указанных в ней соединений. Из букв, соответствующих правильным ответам, вы составите название одной из областей применения поваренной соли: ПРИМЕНЕНИЕ NaOH кон Na2CO3 •10H2O NaHCO3 К2С03 Na2SO4 • 10H2O Очистка нефтепродуктов К У Г М Ю Д Сельское хозяйство X 3 С Ф О А Получение мыла Н С Е Л Р Ы Текстильная промышлен В У Г X Д Э Изготовление бумаги И Ш Р А Ж Ч Производство стекла Ж Т О Ф В А Пищевая промышлен Г Ы У Н С У Медицина Л X М И Я Е к о н с е р в и р о в а н и е

Литий (Lithium) 3Li Литий – самый лёгкий серебристо – белый металл. Открыт в 1817 году шведским химиком А.Арфведсоном при анализе минерала петалита LiAl[Si4O10] С греческого «литеос» - означает «камень».

Натрий (Natrium)11Na Натрий – мягкий, серебристо – белый металл. В чистом виде получен при электролизе едкого натра английским химиком и физиком Гемфри Дэви в 1807 году и назван им « содием». В 1809 г. Л.В.Гильбер предложил название «натроний» (от арабского «натрун» – природная сода). В 1811 г. И.Я.Берцеиус изменил «натроний» на «натрий».

Калий (Kalium) 19K Калий – серебристо-белый, очень мягкий и легкоплавкий металл. Получен при электролизе едкого кали в 1807г. английским химиком и физиком Гемфри Деви и назван им потассием. В 1809 г. Л.В.Гильберт предложил название « калий» (от арабского «аль-кали» - поташ).

Рубидий (Rubidium) 37Rb Рубидий – лёгкий и очень мягкий (как воск),серебристо-белый металл. Открыт в 1861 году по двум неизвестным ранее тёмно-красным линиям в спектре немецкими учёными Р. Бунзеном и Г. Кирхгофом. Цвет этих линий определил название: в переводе с латыни «рубидос»- -«тёмно-красный». «

Цезий (Caesium) 55Cs Блестящая поверхность цезия имеет бледно-золотистый цвет. В 1860 году немецкие учёные Р. Бунзен и Г. Кирхгоф по синим линиям в спектре обнаружили в воде, взятой из минеральных источников Баварии, новый химический элемент. Название элемента: по латыни «цезиус»- «небесно-голубой».

Франций (Franium) 87Fr Возможность существования и основные свойства элемента №87 были предсказаны Д.И.Менделеевым. В 1871 году в статье «Естественная система элементов и применение её к указанию свойств неоткрытых элементов», он писал: «Затем в десятом ряду можно ждать ещё основных элементов, принадлежащим к I, II,III группам. Первый из них должен образовывать окисел- R2O, второй- RO, третий- R2O3 , первый из них будет сходен с цезием, второй- с барием, а все их окиси должны обладать, конечно, характером самых энергичных оснований». Исходя из местоположения экацезия в периодической системе, следовало ожидать, что сам металл будет жидким при комнатной температуре, так как цезий плавиться при 280 С.

Проверь себя (работа с таблицей Д.И. Менделеева) Сравните атомы элементов, поставив знаки или = вместо *: а) заряд ядра: Li * Rb, Na * Al, Ca * К; б) число электронных слоев: Li * Rb, Na * Al, Ca * К; в) число электронов на внешнем уровне: Li * Rb, Na * Al, Ca * К; г) радиус атома: Li * Rb, Na * Al, Ca * K; д) восстановительные свойства: Li * Rb, Na * Al, Ca * K.

Проверь себя 1. Составьте уравнения реакций с кислородом: а) лития ________________ ; б) натрия _______________ Расставьте степени окисления элементов, покажите стрелкой переход электронов. Назовите продукты реакций. Дополните схемы взаимодействия щелочных металлов с неметаллами общими формулами и названиями продуктов реакции. Запишите конкретные уравнения реакций, расставив коэффициенты в них методом электронного баланса. а) М+ Н 2 _____________ в) М+ С12 ___________________ Пример: ___________________ Пример: _________________________ б) М+ S ____________ г) М+ N2 ____________________________ Пример:_______________________________ Пример:___________________________

§ 11 Упр. 1 (письменно) Домашнее задание




![Литий (Lithium) 3Li Литий – самый лёгкий серебристо – белый металл. Открыт в 1817 году шведским химиком А.Арфведсоном при анализе минерала петалита LiAl[Si4O10] С греческого «литеос» - означает «камень». Литий (Lithium) 3Li Литий – самый лёгкий серебристо – белый металл. Открыт в 1817 году шведским химиком А.Арфведсоном при анализе минерала петалита LiAl[Si4O10] С греческого «литеос» - означает «камень».](https://fs3.ppt4web.ru/images/132073/184074/640/img8.jpg)