Презентация на тему: Фосфор

900igr.net

Форфор (phosphorus), неметаллический химический элемент подгруппы азота (VA) периодической системы элементов.

Фосфор занимает 12-е место по распространенности элементов в природе. Он входит в состав многих горных пород и содержится в живых организмах (в костях, зубах и т.д.).
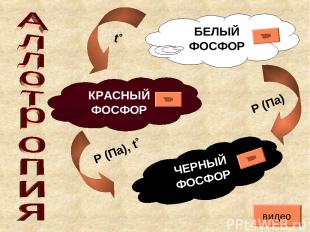
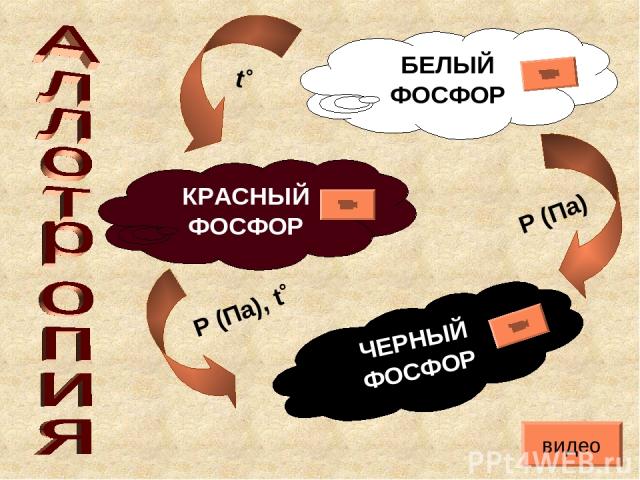
БЕЛЫЙ ФОСФОР КРАСНЫЙ ФОСФОР ЧЕРНЫЙ ФОСФОР Р (Па), t˚ Р (Па) t˚ видео


Взаимодействие с простыми веществами - неметаллами. Фосфор может реагировать со многими неметаллами: кислородом, серой, галогенами, с водородом фосфор не реагирует. В зависимости от того, находится фосфор в избытке или недостатке, образуются соединения фосфора (III) и (V) , например: 2P + 3Br2 = 2PBr3 или 2P + 5Br2 = 2PBr5 4P + 5О2 = 2P2О5 Видео Видео

Взаимодействие с металлами. При нагревании фосфора с металлами образуются фосфиды: 3Mg + 2P = Mg3P2 Фосфиды некоторых металлов могут разлагаться водой с образованием газообразного фосфина PH3: Mg3P2 + 6H2O = 3Mg(OH)2 + 2PH3 Фосфин PH3 по химическим свойствам похож на аммиак NH3.

Взаимодействие с конц. азотной кислотой: 3Р + 5HNO3 + 2H2O = 3H3PO4 + 5NO 0 -3 +1 Р0 + 3е → Р-3 1 ок – ль; вос – ние; Р0 - 1е → Р+1 3 вос – ль; ок – ние; P4 + 3NaOH + 3H2O = PH3 + 3NaH2PO2 Взаимодействие со щелочами. При нагревании белого фосфора в растворе щелочи он диспропорционирует:

Фосфор в промышленности получают из фосфата кальция Ca3(PO4)2, который выделяют из фосфоритов и фторапатитов. Метод получения основан на реакции восстановления Ca3(PO4)2 до фосфора. В качестве восстановителя используют кокс (углерод) . Для связывания соединений кальция добавляют кварцевый песок SiO2. Реакция протекает по уравнению: 2Ca3(PO4)2 + 6SiO2 + 10C = 6CaSiO3 + P4 +10CO

В военных целях Спичечное производство Взрывчатые вещества Фосфорные удобрения Моющие средства Пищевые добавки (БАДы)