Презентация на тему: Фосфор

Фосфор Подготовил учитель химииМОУ СОШ № 16С. АлександровскогоАлександровского районаКононенко Светлана Юрьевна

Тематика презентации рассчитана на учащихся 9х классов Навыки и знания компьютера не требует от учащихся Созданная презентация позволяет учащимся анализировать, оценивать, размышлять, делать выводы, уметь сравнивать, вырабатывать умения самостоятельно работать на уроке. Созданная презентация позволяет учащимся опираясь на ранее полученные знания, познакомить учащихся со свойствами фосфора, строением, получением, аллотропными модификациями, нахождением в природе, области применения. Содержание презентации соответствует утвержденному минимуму знаний по предмету и стандартом обучения. Презентация позволяет каждому ученику почувствовать себя соавтором, соучастником в проведении урока, раскрыть имеющийся потенциал возможностей ученика. Использование современных технологий помогает учащимся выполнять работу быстрее, качественней, и на более глубоком уровне. Целесообразно использовать новые технологии для получения необходимых знаний, умений и навыков по конкретному предмету школьной программы.

Цели урока: Опираясь на ранее полученные знания учащихся, познакомить учащихся со свойствами фосфора как простого вещества, его строением, свойствами, получением. Аллотропные модификации фосфора Нахождение в природе Области применения Развивать у учащихся умение выделять главное, уметь сравнивать, обобщать и развивать мышление, вырабатывать умения самостоятельно работать на уроке.

Девиз урока:«Иногда фосфор может быть дороже любого драгоценного металла»

мотивацияЯ – светоносный элемент, Я спичку вам зажгу в момент, Сгореть смогу и под водой,Оксид в ней станет кислотой.Это - фосфор


"визитка химического элемента" порядковый номер: период: группа: подгруппа:

Валентные возможности фосфора В электронно-возбужденном состоянии образуется 5ковалентных связей. До завершения р-подуровня не хватает 3х электронов, поэтому они могут их принимать при взаимодействии с сильными восстановителями, либо при взаимодействии с неметаллами. В соединениях проявляет следующие степени окисления -3, 0, +3, +5.
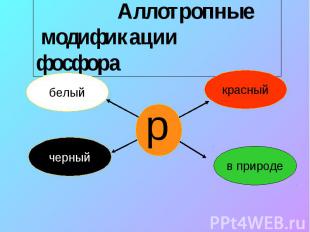
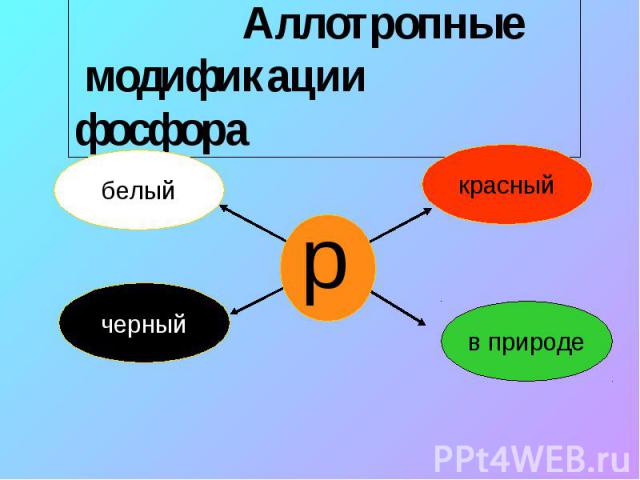
Аллотропные модификации фосфора

молекула белого фосфора Молекула белого фосфора имеет формулу тетраэдра. Это легкоплавкое Тпл =44,10 С, Ткип=275 оС, мягкое, бесцветное, воскообразное вещество. Хорошо растворимое в сероуглероде и ряде других органических растворителях. Ядовит, воспламеняется на воздухе, светится в темноте. Хранят его под слоем воды.
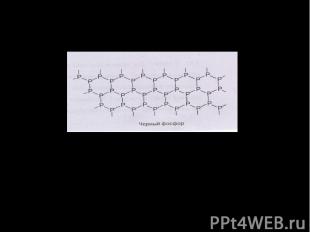
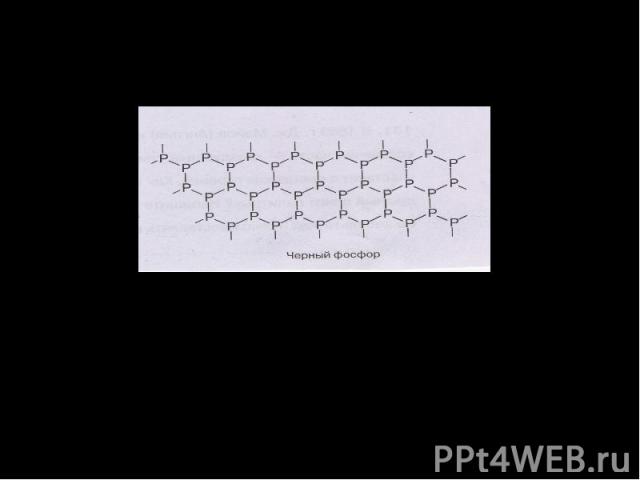
Кристаллическая решетка Черного фосфора. Черный фосфор имеет слоистую атомную кристаллическую решетку. По внешнему виду похож на графит, но является полупроводником. Не ядовит.
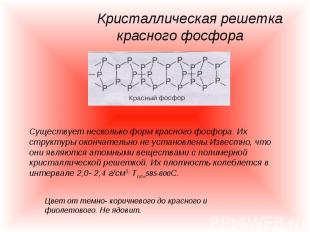
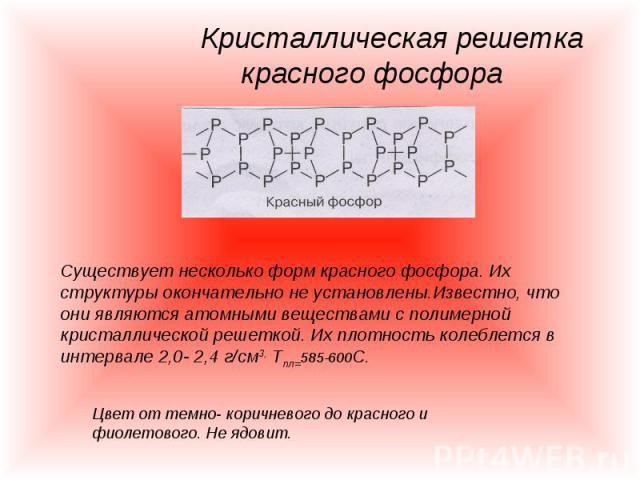
Кристаллическая решетка красного фосфора Существует несколько форм красного фосфора. Их структуры окончательно не установлены.Известно, что они являются атомными веществами с полимерной кристаллической решеткой. Их плотность колеблется в интервале 2,0- 2,4 г/см3, Тпл=585-600С.

Фосфор встречается только в химически связанном виде : в организме и минералах. В живых организмах фосфор содержится в виде фосфолипидов (МОЗГОВОМ ВЕЩЕСТВЕ), ФОСФОПРОТЕИДОВ(ФЕРМЕНТЫ), РАЗЛИЧНЫХ ЭФИРОВ ОРТОФОСФОРНОЙ КИСЛОТЫ И ОРТОФОСФАТА КАЛЬЦИЯ(В КОСТЯХ, ЗУБАХ).

Взаимодействие фосфора с кислородом Р4+ 5О2 =Р4О10 самовоспламенение на воздухе В обычных условиях химическая активность фосфора во многом зависит, в какой аллотропной форме он находится. Самым активным является белый фосфор, за счет малой прочности Р-Р связи в молекуле Р4

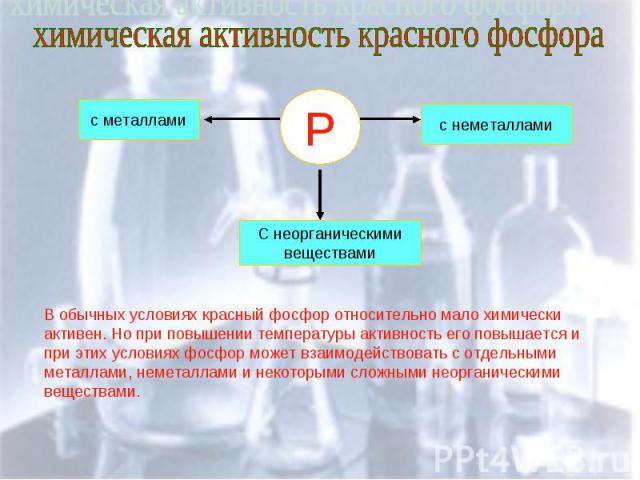
химическая активность красного фосфора В обычных условиях красный фосфор относительно мало химически активен. Но при повышении температуры активность его повышается и при этих условиях фосфор может взаимодействовать с отдельными металлами, неметаллами и некоторыми сложными неорганическими веществами.

взаимодействие фосфора с металлами Фосфор относительно легко реагирует со щелочными и щелочноземельными металлами. Металлические производные называются ФОСФИДАМИ. Эти вещества неустойчивы по отношению к воде и растворам кислот, которые необратимо разлагаются. Ca3P2 + H2O = Ca(OH)2 + PH3

взаимодействие фосфора с неметаллами 4P + 3O2 = P4O6 (при недостатке кислорода) P4 + 5O2 = P4O10 (при избытке кислорода) 2P + 5F2 = 2PF5 2P + 3CI2 = 2PCI3 (30-400C) Наиболее легко идут реакции с кислородом и галогенами.

Взаимодействие фосфора с неорганическими соединениями При повышенной температуре фосфор может реагировать с отдельными неорганическими веществами, прежде всего с сильными окислителями, водой, растворяется в щелочах.

Промышленный способ получения В промышленности фосфор получают из фосфоритов и апатитов. Метод основан на реакции восстановления Ca3(PO4)2 коксом до фосфора. Для связывания соединений кальция добавляют кварцевый песок (SIO2). Процесс проводят в электропечах. Продукт реакции- белый фосфор, который затем длительным нагреванием превращают в красный.


молодец

попробуй еще

Какие из указанных неметаллов образуют водородные соединения типа ЭН3?

Какая химическая ошибка была допущена в произведении? …. Да! Это была собака, огромная, черная, как смоль. Но такой собаки еще никто из нас, смертных, не видывал. Из ее открытой пасти вырывалось пламя, по морде и загривку переливался мерцающий огонь…Я дотронулся до этой светящейся головы и, отняв руку, увидел, что мои пальцы тоже засветились в темноте.«Фосфор», - сказал я.А. Конан Дойл.«Собака Баскервилей»

домашнее задание На основе опорного конспекта составьте рассказ по данной теме.

Желаю удачи с уважением Кононенко С.Ю.