Презентация на тему: Характеристика углерода и кремния

Химия элементов. Лекция 1 Общая характеристика элементов IVA-группы. Углерод и кремний 900igr.net
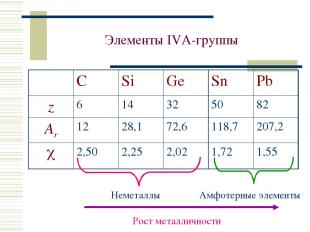
Элементы IVА-группы Неметаллы Амфотерные элементы C Si Ge Sn Pb z 6 14 32 50 82 Ar 12 28,1 72,6 118,7 207,2 2,50 2,25 2,02 1,72 1,55
![Общая электронная формула: […] ns 2 (n–1)d 10np2 Валентные возможности: С: 2, 4; Общая электронная формула: […] ns 2 (n–1)d 10np2 Валентные возможности: С: 2, 4;](https://fs3.ppt4web.ru/images/132073/184073/310/img2.jpg)
Общая электронная формула: […] ns 2 (n–1)d 10np2 Валентные возможности: С: 2, 4; Si, Ge, Sn, Pb: 2 6 Степени окисления: –IV, 0, +II, +IV Устойчивые ст.ок.: С, Si, Ge, Sn: +IV (PbIV – сильн.окисл.). Уст. ст.ок.: Pb: +II
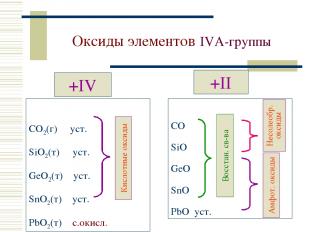
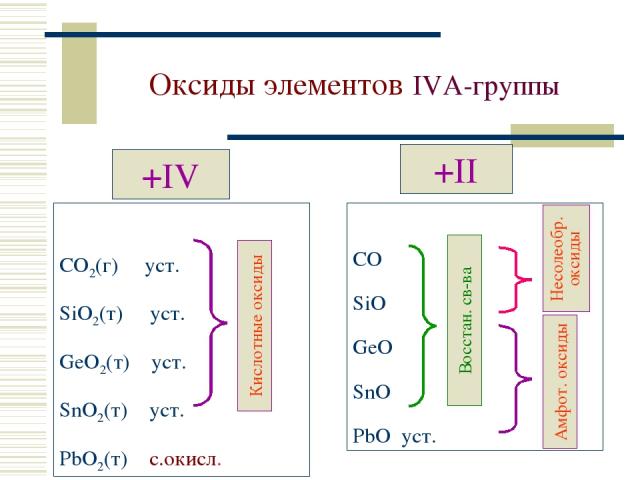
Оксиды элементов IVА-группы +IV CO2(г) уст. SiO2(т) уст. GeO2(т) уст. SnO2(т) уст. PbO2(т) с.окисл. +II CO SiO GeO SnO PbO уст.
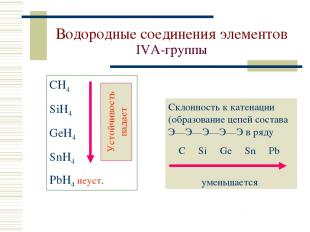
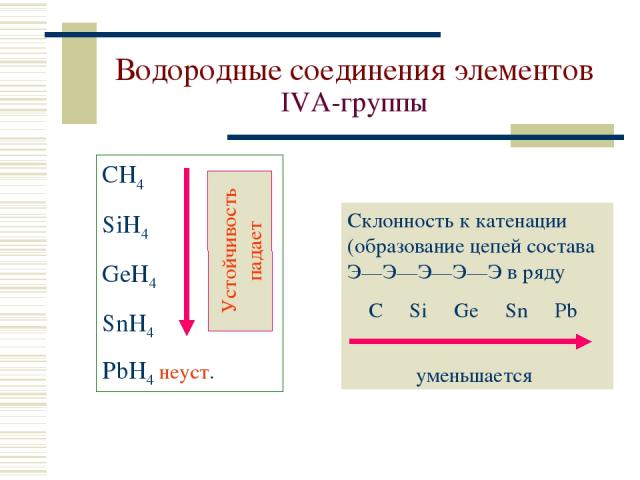
Водородные соединения элементов IVА-группы СH4 SiH4 GeH4 SnH4 PbH4 неуст. Склонность к катенации (образование цепей состава Э—Э—Э—Э—Э в ряду C Si Ge Sn Pb
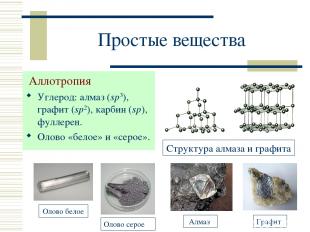
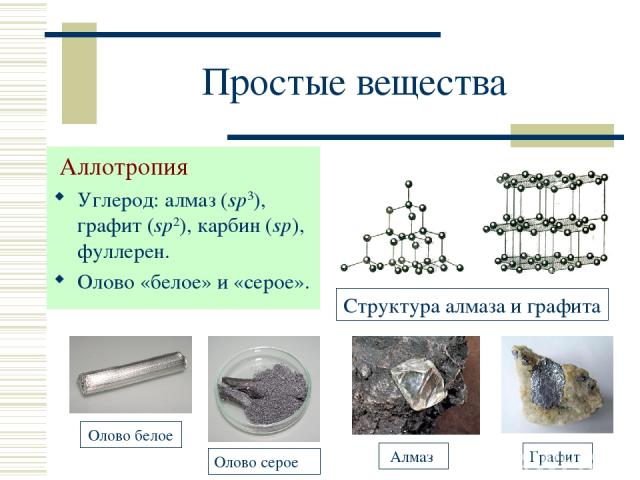
Простые вещества Аллотропия Углерод: алмаз (sp3), графит (sp2), карбин (sp), фуллерен. Олово «белое» и «серое». Структура алмаза и графита

Химические свойства При комн. темп. С, Si, Ge + H2O С, Si, Ge + H3O+ Sn, Pb + H2O Sn + H3O+ Sn2+ + H2 Pb + H3O+ Pb2+ + H2

Химические свойства С(т) + KOH Si + 4NaOH = Na4SiO4 + 2H2 Si + 8OH– –4e – = SiO44– + 4H2O 2H2O + 2e – = H2 + 2OH– Ge + 2KOH + 2H2O2 = K2[Ge(OH)6] Ge + 6OH– –4e – = [Ge(OH)6]2– H2O2 + 2e – = 2OH– Sn + NaOH + 2H2O = Na[Sn(OH)3] + H2 Sn + 3OH– –2e – = [Sn(OH)3]– 2H2O + 2e – = H2 + 2OH–
![Простые вещества ЭIVA ЭГ2, ЭГ4 (Sn, Pb) ЭO, ЭO2 (Sn, Pb) ЭS, ЭS2 SiO44– [Э(OH)3] Простые вещества ЭIVA ЭГ2, ЭГ4 (Sn, Pb) ЭO, ЭO2 (Sn, Pb) ЭS, ЭS2 SiO44– [Э(OH)3]](https://fs3.ppt4web.ru/images/132073/184073/310/img8.jpg)
Простые вещества ЭIVA ЭГ2, ЭГ4 (Sn, Pb) ЭO, ЭO2 (Sn, Pb) ЭS, ЭS2 SiO44– [Э(OH)3]– + H2 (Sn, Pb) Э2+ + H2 (Sn, Pb) CO2, Pb2+, SnO2 · nH2O Sn2+, Pb2+

Распространение в природе и важнейшие минералы 2. Si 25,80% (27,72% в литосфере) 13. C 0,087% (0,032% в литосфере) 31. Sn 0,0035% 35. Pb 0,0018% 46. Ge 6 ·10–4% (РРЭ) Кремний: кварц, яшма, агат, опал, силикаты, алюмосиликаты

Углерод: графит, алмаз, каменный уголь, нефть, природный газ, орг. в-ва, карбонаты

Германий, олово и свинец

Шкала степеней окисления углерода CO2, CO32 , H2CO3, Na2CO3, CS2, CF4, CCl2O, C(NH2)2O CO, HCN, C2F4 C (графит, алмаз, карбин, фуллерен) СH4, Be2C, Al4C3, SiC

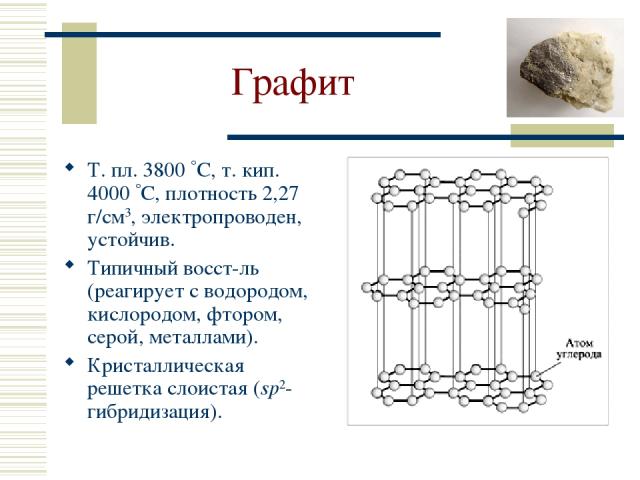
Графит Т. пл. 3800 С, т. кип. 4000 С, плотность 2,27 г/см3, электропроводен, устойчив. Типичный восст-ль (реагирует с водородом, кислородом, фтором, серой, металлами). Кристаллическая решетка слоистая (sp2-гибридизация).

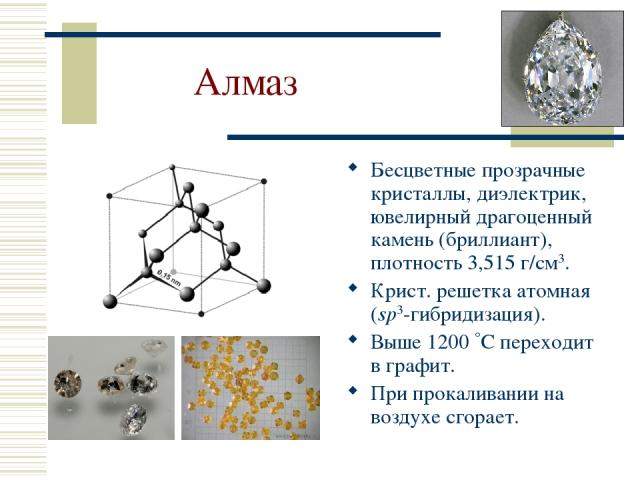
Алмаз Бесцветные прозрачные кристаллы, диэлектрик, ювелирный драгоценный камень (бриллиант), плотность 3,515 г/см3. Крист. решетка атомная (sp3-гибридизация). Выше 1200 С переходит в графит. При прокаливании на воздухе сгорает.

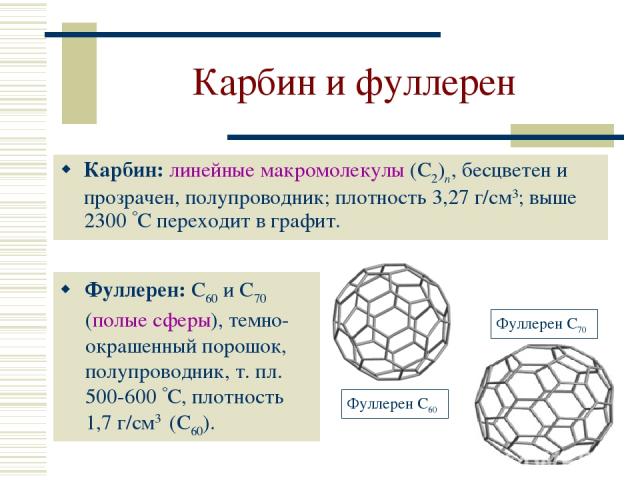
Карбин и фуллерен Карбин: линейные макромолекулы (С2)n, бесцветен и прозрачен, полупроводник; плотность 3,27 г/см3; выше 2300 С переходит в графит. Фуллерен: С60 и С70 (полые сферы), темно-окрашенный порошок, полупроводник, т. пл. 500-600 C, плотность 1,7 г/см3 (С60).
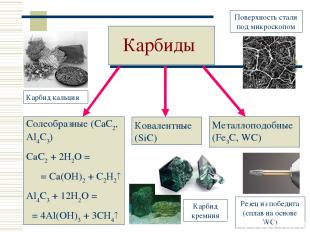
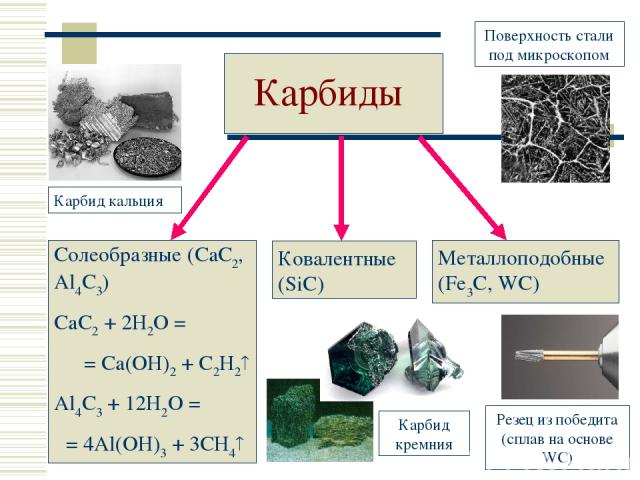
Карбиды

Водородные соединения. Метан CH4 СН4 – газ без цвета и запаха, горюч, главная сост. часть природного газа. Получение в лаборатории: CH3COONa + NaOH (+t) = = Na2CO3 + CH4 Горение: CH4 + O2 = С + 2H2O CH4 + 2O2 (изб.) = = СO2 + 2H2O sp3
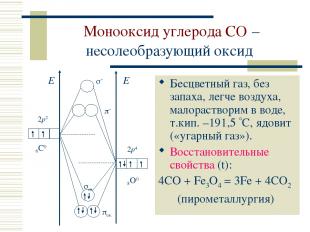
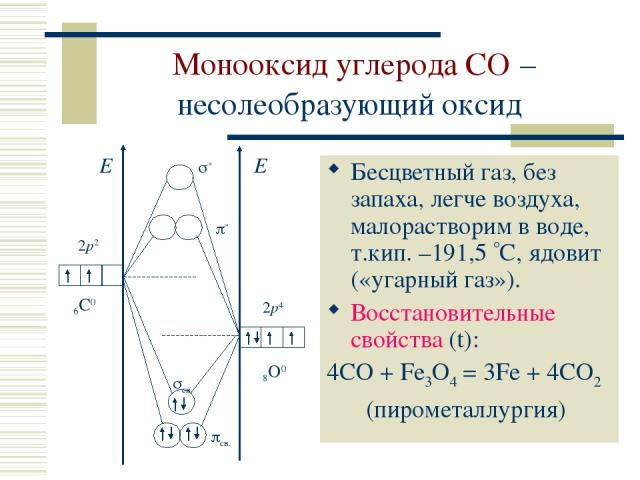
Монооксид углерода CO – несолеобразующий оксид Бесцветный газ, без запаха, легче воздуха, малорастворим в воде, т.кип. –191,5 С, ядовит («угарный газ»). Восстановительные свойства (t): 4CO + Fe3O4 = 3Fe + 4CO2 (пирометаллургия)

Монооксид углерода CO Донорные свойства: CO образует прочные комплексы, например [Fe(CO)5]. : C ::: O Обнаружение: PdCl2 + CO + H2O = Pd + CO2 + 2HCl I2O5 + 5CO = I2 + 5CO2

Диоксид углерода CO2 (кислотный оксид) Бесцветный газ, без запаха, тяжелее воздуха, умеренно растворим в воде (при комн. т-ре в 1 л воды – около 1,7 л CO2). В тв. сост. («сухой лёд») – молекулярная крист. решетка; т. возгонки –78 С, т.пл. –57 С (р = 5 атм). sp-гибридизация

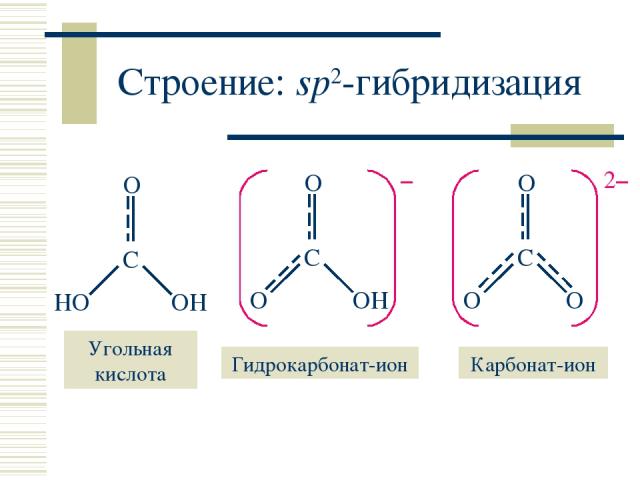
Моногидрат CO2 . H2O и угольная кислота H2CO3 В водном растворе: CO2 (г) + H2O CO2 . H2O H2CO3 H2CO3 – слабая двухосновная кислота: H2CO3 + H2O HCO3– + H3O+ ; KK = 4,27 · 10–7 HCO3– + H2O CO32– + H3O+ ; KK = 4,68 · 10–11 Соли – карбонаты и гидрокарбонаты M2CO3 и MHCO3 подвергаются гидролизу (рН > 7). Термическое разложение гидрокарбонатов: 2NaHCO3 = Na2CO3 + CO2 + H2O Видеофрагмент
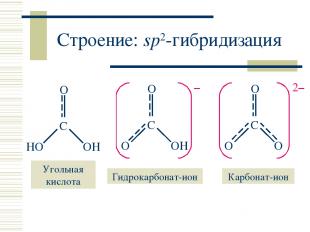
Строение: sp2-гибридизация
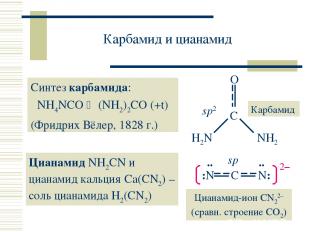
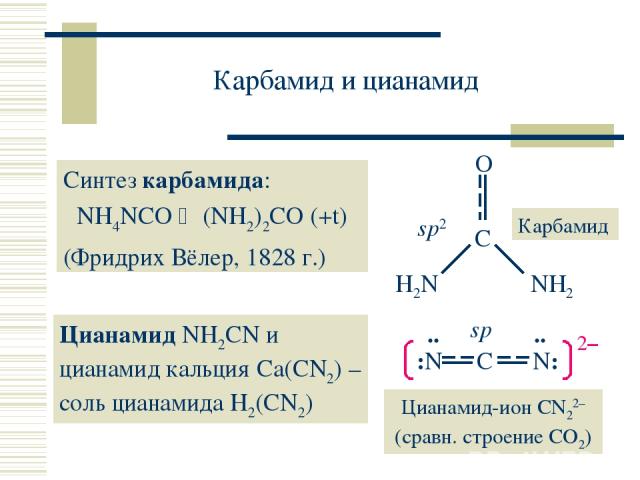
Карбамид и цианамид Синтез карбамида: NH4NCO (NH2)2CO (+t) (Фридрих Вёлер, 1828 г.) Цианамид NH2CN и цианамид кальция Ca(CN2) – соль цианамида H2(CN2)

Псевдогалогениды Циановодород HCN – бесцв.ж., т. пл. –13,3 С, т.кип. +25,6 С). В водн. р-ре – слабая «синильная кислота»: HCN + H2O CN– + H3O+; KK = 4,93 · 10–10 Цианид-ион CN : донорные св-ва, образует прочные комплексы, ядовит. : C:::N– HCN – производное дициана C2N2
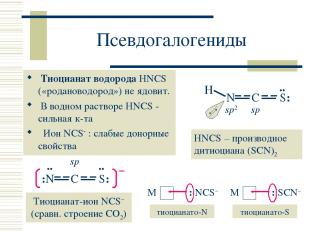
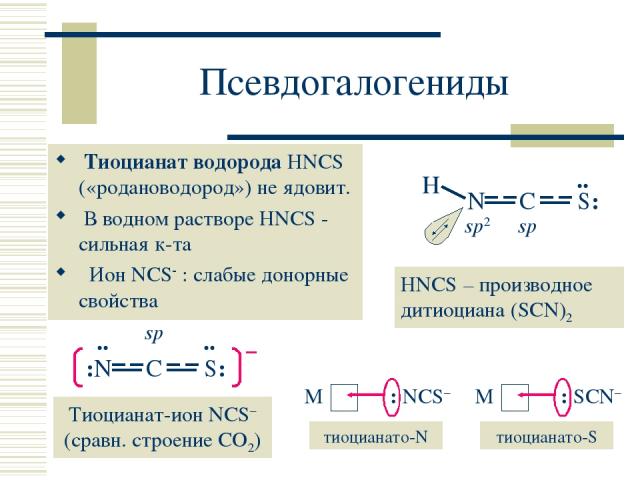
Псевдогалогениды Тиоцианат водорода HNCS («родановодород») не ядовит. В водном растворе HNCS - сильная к-та Ион NCS : слабые донорные свойства HNCS – производное дитиоциана (SCN)2
![Кремний Химическое растворение 3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O Si + Кремний Химическое растворение 3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O Si +](https://fs3.ppt4web.ru/images/132073/184073/310/img26.jpg)
Кремний Химическое растворение 3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O Si + 4NaOH = Na4SiO4 + 2H2 Получение кремния SiO2 + 2Mg = 2MgO + Si SiCl4 + 2H2 = Si + 4HCl (кремний ос.ч.)

Водородные соединения SinH2n+2 (силаны) Моносилан SiH4: SiH4 + 2O2 = SiO2 + 2H2O Получение силанов: SiO2 + 4Mg(изб) = Mg2Si + 2MgO (силицид магния) Mg2Si + 4H2O = 2Mg(OH)2 + SiH4 Mg2Si + 4H3O+ = 2Mg2+ + 4H2O + SiH4 Видео: магниетермия и получение силана

Кислородные соединения Полиморфизм диоксида кремния: кварц тридимит кристобалит SiO2(ж) (расплав) SiO2 GeO2 + H2O SiO2 + 4NaOH(р) = Na4SiO4 + 2H2O (ортосиликат натрия) GeO2 + 2NaOH(т) = Na2GeO3 + H2O (метагерманат натрия) SiO2 GeO2 + H3O+
![Травление стекла SiO2 + 4HF = SiF4 + 2H2O SiO2 + 6HF (изб.) = H2[SiF6] + 2H2O (г Травление стекла SiO2 + 4HF = SiF4 + 2H2O SiO2 + 6HF (изб.) = H2[SiF6] + 2H2O (г](https://fs3.ppt4web.ru/images/132073/184073/310/img29.jpg)
Травление стекла SiO2 + 4HF = SiF4 + 2H2O SiO2 + 6HF (изб.) = H2[SiF6] + 2H2O (гексафторосиликат водорода)
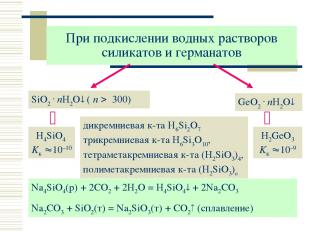
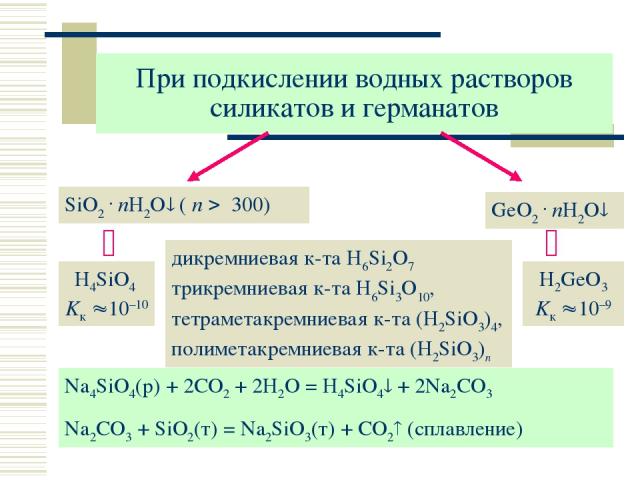
При подкислении водных растворов силикатов и германатов SiO2 . nH2O ( n 300) дикремниевая к-та H6Si2O7 трикремниевая к-та H6Si3O10, тетраметакремниевая к-та (H2SiO3)4, полиметакремниевая к-та (H2SiO3)n GeO2 . nH2O H4SiO4 Kк 10–10 H2GeO3 Kк 10–9 Na4SiO4(р) + 2CO2 + 2H2O = H4SiO4 + 2Na2CO3 Na2CO3 + SiO2(т) = Na2SiO3(т) + CO2 (сплавление)



![Общая электронная формула: […] ns 2 (n–1)d 10np2 Валентные возможности: С: 2, 4; Si, Ge, Sn, Pb: 2 6 Степени окисления: –IV, 0, +II, +IV Устойчивые ст.ок.: С, Si, Ge, Sn: +IV (PbIV – сильн.окисл.). Уст. ст.ок.: Pb: +II Общая электронная формула: […] ns 2 (n–1)d 10np2 Валентные возможности: С: 2, 4; Si, Ge, Sn, Pb: 2 6 Степени окисления: –IV, 0, +II, +IV Устойчивые ст.ок.: С, Si, Ge, Sn: +IV (PbIV – сильн.окисл.). Уст. ст.ок.: Pb: +II](https://fs3.ppt4web.ru/images/132073/184073/640/img2.jpg)

![Химические свойства С(т) + KOH Si + 4NaOH = Na4SiO4 + 2H2 Si + 8OH– –4e – = SiO44– + 4H2O 2H2O + 2e – = H2 + 2OH– Ge + 2KOH + 2H2O2 = K2[Ge(OH)6] Ge + 6OH– –4e – = [Ge(OH)6]2– H2O2 + 2e – = 2OH– Sn + NaOH + 2H2O = Na[Sn(OH)3] + H2 Sn + 3OH– –2e – = … Химические свойства С(т) + KOH Si + 4NaOH = Na4SiO4 + 2H2 Si + 8OH– –4e – = SiO44– + 4H2O 2H2O + 2e – = H2 + 2OH– Ge + 2KOH + 2H2O2 = K2[Ge(OH)6] Ge + 6OH– –4e – = [Ge(OH)6]2– H2O2 + 2e – = 2OH– Sn + NaOH + 2H2O = Na[Sn(OH)3] + H2 Sn + 3OH– –2e – = …](https://fs3.ppt4web.ru/images/132073/184073/640/img7.jpg)
![Простые вещества ЭIVA ЭГ2, ЭГ4 (Sn, Pb) ЭO, ЭO2 (Sn, Pb) ЭS, ЭS2 SiO44– [Э(OH)3]– + H2 (Sn, Pb) Э2+ + H2 (Sn, Pb) CO2, Pb2+, SnO2 · nH2O Sn2+, Pb2+ Простые вещества ЭIVA ЭГ2, ЭГ4 (Sn, Pb) ЭO, ЭO2 (Sn, Pb) ЭS, ЭS2 SiO44– [Э(OH)3]– + H2 (Sn, Pb) Э2+ + H2 (Sn, Pb) CO2, Pb2+, SnO2 · nH2O Sn2+, Pb2+](https://fs3.ppt4web.ru/images/132073/184073/640/img8.jpg)





![Монооксид углерода CO Донорные свойства: CO образует прочные комплексы, например [Fe(CO)5]. : C ::: O Обнаружение: PdCl2 + CO + H2O = Pd + CO2 + 2HCl I2O5 + 5CO = I2 + 5CO2 Монооксид углерода CO Донорные свойства: CO образует прочные комплексы, например [Fe(CO)5]. : C ::: O Обнаружение: PdCl2 + CO + H2O = Pd + CO2 + 2HCl I2O5 + 5CO = I2 + 5CO2](https://fs3.ppt4web.ru/images/132073/184073/640/img19.jpg)



![Кремний Химическое растворение 3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O Si + 4NaOH = Na4SiO4 + 2H2 Получение кремния SiO2 + 2Mg = 2MgO + Si SiCl4 + 2H2 = Si + 4HCl (кремний ос.ч.) Кремний Химическое растворение 3Si + 4HNO3 + 18HF = 3H2[SiF6] + 4NO + 8H2O Si + 4NaOH = Na4SiO4 + 2H2 Получение кремния SiO2 + 2Mg = 2MgO + Si SiCl4 + 2H2 = Si + 4HCl (кремний ос.ч.)](https://fs3.ppt4web.ru/images/132073/184073/640/img26.jpg)


![Травление стекла SiO2 + 4HF = SiF4 + 2H2O SiO2 + 6HF (изб.) = H2[SiF6] + 2H2O (гексафторосиликат водорода) Травление стекла SiO2 + 4HF = SiF4 + 2H2O SiO2 + 6HF (изб.) = H2[SiF6] + 2H2O (гексафторосиликат водорода)](https://fs3.ppt4web.ru/images/132073/184073/640/img29.jpg)