Презентация на тему: Подготовка к ЕГЭ: Кислородсодержащие органические соединения. Карбоновые кислоты
Подготовка к ЕГЭ: Кислородсодержащие органические соединения. КАРБОНОВЫЕ КИСЛОТЫ.Муниципальное бюджетное общеобразовательное учреждение «Средняя общеобразовательная школа №9 с углубленным изучением отдельных предметов» Елабужского муниципального района Республики Татарстан.Автор: учитель химии Леонтьева Наталия Викторовна

Органические карбоновые кислоты характеризуются наличием карбоксильной группы –СООНПо числу групп различают: одно- СН3-СООН – уксусная или этановая кислота, двух- НООС-СООН- щавелевая или этандиовая кислота, трех-, и многоосновные кислоты.Органические кислоты могут быть: предельными – СН3-СН2-СООН –пропионовая или пропановая кислота; непредельными – СН2=СН-СООН акриловая или пропеновая кислота. ароматическими – С6Н5-СООН

Номенклатура карбоновых кислот:Формула тривиальная систематическая ИЮПАК НСООН муравьиная метановая СН3СООН уксусная этановая СН3СН2СООН пропионовая пропановая СН3(СН2)2СООН масляная бутановая СН3(СН2)3СООН валериановая пентановая СН3(СН2)4СООН капроновая гексановая СН3(СН2)5СООН энантовая гептановая СН3(СН2)10СООН лауриновая додекановаяСН3(СН2)16СООН стеариновая октадекановая С6Н5-СООН бензолкарбоновая бензойная СН2=СН-СООН пропеновая акриловаяРадикалы кислот - ацилы-, например: Н-СО- формил, метаноил (радикал муравьиной кислоты) .

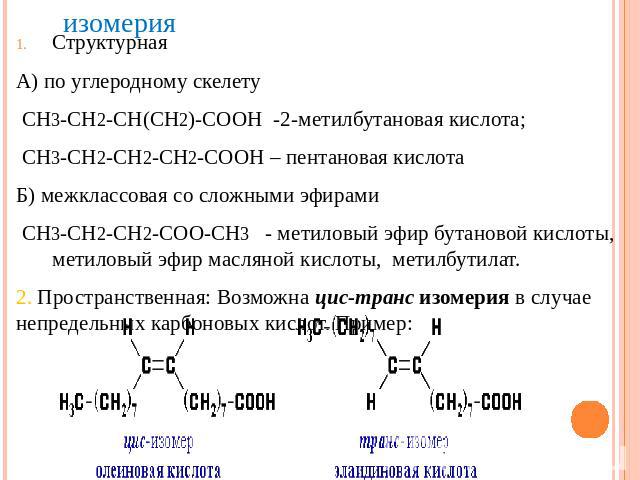
изомерияСтруктурная А) по углеродному скелету СН3-СН2-СН(СН2)-СООН -2-метилбутановая кислота; СН3-СН2-СН2-СН2-СООН – пентановая кислотаБ) межклассовая со сложными эфирами СН3-СН2-СН2-СОО-СН3 - метиловый эфир бутановой кислоты, метиловый эфир масляной кислоты, метилбутилат.2. Пространственная: Возможна цис-транс изомерия в случае непредельных карбоновых кислот. Пример:

Физические свойстваС1-С3- легкоподвижные бесцветные жидкости, неограниченно смешиваются с водой, с характерным острым запахом .С4-С9-вязкие маслянистые жидкости с неприятным запахом, растворимость падает с ростом С.>С9 –твердые вещества, не растворимы в воде.

Химические свойства- кислотные:Электроакцепторные заместители усиливают силу кислот;Электродонорные заместительные понижают силу кислот;Двухосновные кислоты более сильные, чем одноосновные;Сила кислот увеличивается в ряду: уксусная-хлоруксусная-дихлоруксусная-трихлоруксусная кислота.Сильные кислоты вытесняют карбоновые из их солей.

Общие с кислотами Диссоциация в водном растворе:СН3СООНСН3СОО+НВзаимодействие с активными металлами:2СН3СООН + 2Na 2СН3СООNa + H23. Взаимодействие с оксидами металлов: СН3СООН + Na2O СН3СООNa + H2O4. Взаимодействие с основаниями:СН3СООН + NaOH СН3СООNa + H2O5. Взаимодействие с солями более слабых к-т: СН3СООН + NaHCO3 СН3СООNa + CO2 +H2O

Специфические свойства карбоновых кислот:Восстанавливаются до альдегидов и спиртов: CH3COOH +2[H](кат)CH3CHO + H2O CH3COOH +4[H] (кат) CH3CH2OH+H2O2. Реакции замещения:СН3СООН + CL2(PCL5) CH2CL-COOH +HCL3. Реакция этерификации:СH3-COOH + CH3OH CH3-COOCH3 + H2O4. Образование хлорангидридов кислот:СН3СООН + PCL5 CH3OCL+POCL3+HCL

Декарбоксилирование двухосновных карбоновых кислот1.HOOC-CH2-COOH(70C)CH3COOH+CO2 Непредельные карбоновые кислоты могут вступать в реакции присоединения: гидрирования, галогенирования, гидрогалогенирования.При горении образуются СО2 и Н2О

Специфические свойства муравьиной кислоты:По карбонильной группе А) реакция серебряного зеркала.HCOOH+2[Ag(NH3)2]OH2Ag+CO2+H2O+4NH3Б) реакция с гидроксидом меди (II).HCOOH+2Cu(OH)2 CO2+Cu2O+H2O2. разложение:HCOOH(H2SO4k)CO+H2O3. Окисление хлором:HCOOH + CL2 CO2 + 2HCLКстати: Английский естествоиспытатель Джон Рей впервые исследовал муравьиную кислоту еще в 1670 году. Выделена она была из ядовитых железок муравьев, им она и обязана своим названием. В несколько меньшем количестве муравьиную кислоту содержат: еловая хвоя, крапива.
![Получение:Окисление альдегидов и первичных спиртов:CH3CHO + [O]CH3COOHCH3CH2-OH+ Получение:Окисление альдегидов и первичных спиртов:CH3CHO + [O]CH3COOHCH3CH2-OH+](/images/8/18934/310/img10.jpg)
Получение:Окисление альдегидов и первичных спиртов:CH3CHO + [O]CH3COOHCH3CH2-OH+ [O] CH3COOH2. Гидролиз галогенозамещенных углеводородов, содержащих три атома галогена у одного атома углерода:СH3-CCL3 + 3NaOHCH3-COOH +3NaCL3. Гидролиз сложных эфиров : R-COOR1+H2ORCOOH+ROH4. Гидролиз ангидридов кислот: (RCO)2O+H2O2RCOOH5. Окисление муравьиной кислоты раствором перманганата калия: НСООН + [О]= H2О + CO2

Специфические способы получения:Муравьиной кислоты: NaOH+CO(t,p)HCOONa HCOONa + H2SO4HCOOH + NaHSO4Уксусной кислоты: а)из метилового спирта CH3OH + CO(k,t) CH3COOH б) каталитическое окисление углеводородов 2С4H10 + 5O2(k) 4CH3COOH + 2H2O в) ферментативное брожение C2H5OH +O2(ферменты) CH3COOH+H2O

Особые способы получения бензойной кислоты (ароматическая карбоновая кислота):Окисление толуола:5С6H5-CH3 + 6KMnO4 + 9H2SO45C6H5COOH+ 3K2SO4+6MnSO4+14H2O2. По реакции Канниццаро (окисление бензальдегида):2С6H5-CHO(40%NaOH)C6H5COOH+C6H5CH2OH

Уксусная кислота взаимодействует с веществами:ХлорЭтиленгликольАзотГидроксид железа(III)ЦиклопентанТолуолОтвет: 1,2,4

Метилметакрилат взаимодействует с каждым из веществ указанных в рядах:Бромная водаАммиакВодородРаствор едкого натраОксид серебраАзотОтвет:1,3,4

В каких рядах кислоты расположены в порядке увеличения кислотных свойств:пропионоваяуксуснаямуравьинаяХлоруксуснаяуксуснаямуравьинаяУксуснаяхлоруксуснаядихлоруксуснаяДихлоруксуснаяхлоруксуснаяуксуснаяБутановаяуксуснаямуравьинаяМуравьинаяуксусная22-диметилпропановаяОтвет: 1,3,5

К реакциям окисления, характеризующим свойства кислородсодержащих соединений, относятся:RCHO + Ag2ORCOOH + 2AgR-OH +HONO2 RONO2 + H2O2ROH R-O-R + H2ORCHO + CuO RCHO + Cu + H2ORCHO + H2 RCH2OH2RCHO + O2 2RCOOHОтвет:1,4,6

Изомасляная кислота может взаимодействовать с:Карбонатом кальцияМагниемХлоридом натрияПропанолом-1СеребромЙодомОтвет: 1,2,4

Для муравьиной кислоты характерны следующие свойства:Внутримолекулярная дегидратацияВзаимодействует с раствором бихромата калия в серной кислотеСпособна замещать атомы водорода в молекуле фенолаОдинакова по силе с уксусной кислотойРеагирует как с карбонатом, так и с сульфатом натрияОбразует сложный эфир с метаноломОтвет: 1,2,6

Продуктами гидролиза сложных эфиров состава С6Н12О2 могут быть:Метановая кислота и пентанолЭтилацетат и пропанальМасляная кислота и этанолПропановая кислота и пропанолБутаналь и этанЭтилформиат и этанолОтвет: 1,3,4

Вещество, имеющее формулу СН=С(СН3)-СООН,характеризуют следующие признаки:Взаимодействие с бромной водойПрисоединение азотаРеакция с водным р-м гидроксида натрияПрисоединение хлорида натрияВзаимодействие с метаном в присутствии катализатораПолимеризацияОтвет: 1,3,6

Как с уксусной кислотой, так и с муравьиным альдегидом могут реагировать:AgNO3CH3OHCuSO4Cu(OH)2O2C6H5OHОтвет: 2,4,5

С гидроксидом меди(II) может взаимодействовать:1) этилацетат2) этандиол -1,23) формальдегид4) этановая кислота5) пропанол-16) пропанол-2Ответ: 2,3,4

С гидроксидом меди (II) может взаимодействовать:ЭтилацетатГлюкозаПропанальМетановая кислотаПропанол-1Пропанол-2Ответ: 2,3,4

Муравьиная кислота взаимодействует с веществами:Оксидом углерода (IV)АзотомКарбонатом кальцияХлороводородомПропанолом-1Аммиачным раствором оксида серебраОтвет: 3,5,6

Пропионовая кислота реагирует с:Гидроксидом калияБромной водой.Уксусной кислотой.Пропанолом-1СеребромМагнием.Ответ: 1,4,6

Муравьиная кислота взаимодействует с веществами:Оксидом кремния (IV).УглеродомКарбонатом натрияХлороводородомЭтаноломАммиачным раствором оксида серебра.Ответ: 3,5,6

Муравьиная кислота взаимодействует с веществами:Оксидом кремния (IV).азотомКарбонатом калиябромоводородомЭтаноломГидроксидом меди (II)Ответ: 3,5,6

В соответствии со схемой реакции R-COOH + HO-R1 R-COOR1 + H2O происходит взаимодействие между:Серной кислотой и пропанолом-1Метилпропионатом и этаноломПропановой кислотой и этаноломМетанолом и этаноломБутанолом-1 и муравьиной кислотойЭтановой кислотой и метаноломОтвет: 3, 5, 6

Пропионовая кислота реагирует:С гидроксидом калия.Бромной водой.Уксусной кислотой.Пропанолом-1Серебром.Магнием.Ответ: 1,4,6

В соответствии со схемой реакции R-COOH + HO-R1 R-COOR1 + H2Oпроисходит взаимодействие между:Серной кислотой и метаноломМетилпропионатом и этаномМасляной кислотой и пропанолом-1Пропанолом-1 и бутанолом-2Бутанолом-1 и олеиновой кислотойПальмитиновой кислотой и метаноломОтвет: 3,5,6

Муравьиная кислота взаимодействует с веществами:Оксидом азота (II).Серой.Аммиаком.Хлоридом алюминия.Водородом.Гидроксидом меди (II).Ответ: 3,5,6

Уксусная кислота может реагировать с каждым из двух веществ:Метанолом и серебромГидроксидом меди (II) и метанолом.Серебром и гидроксидом меди (II).Магнием и метаном.Ответ: 2

Метиловый эфир уксусной кислоты образуется при взаимодействии:Метановой кислоты и метаналя.Уксусной кислоты и метана.Метанола и уксусного альдегида.Уксусной кислоты и метанола.Ответ: 4

Метилацетат и пропановая кислота - этоГомологиСтруктурные изомерыГеометрические изомерыОдно и то же веществоОтвет: 2

Для муравьиной кислоты не характерна реакцияЭтерификации«Серебряного зеркала»ПолимеризацииНейтрализацииОтвет: 3

Лампочка прибора для испытания электропроводности наиболее ярко горит в раствореУксусной кислотыЭтилового спиртаСахараХлорида натрияОтвет: 4

Уксусную кислоту можно получить в реакцииАцетата натрия с концентрированной серной кислотойВосстановления ацетальдегидаХлорэтана и раствора щелочиЩелочного гидролиза метилацетатаОтвет: 1

В порядке усиления кислотных свойств расположены кислотыСтеариновая – уксусная – трихлоруксуснаяУксусная – стеариновая – трихлоруксуснаяТрихлоруксусная – уксусная – стеариноваяТрихлоруксусная – стеариновая – уксуснаяОтвет: 1

Для уксусной кислоты характерныsp3 –гибридное состояние всех атомов углеродаОбразование водородных связей между молекуламиВзаимодействие с карбонатом натрияРеакции замещения с хлоромБолее сильные кислотные свойства по сравнению с муравьиной кислотойЛинейное строение молекулы Ответ: 2,3,4

При кислотном гидролизе этилацетата образуетсяЭтанол и муравьиная кислотаМетанол и уксусная кислотаМетанол и муравьиная кислотаЭтанол и уксусная кислотаОтвет: 4

В схеме превращений: С6Н6Xбензойная кислота, веществом Х являетсяНитробензолФенолДиметилбензолТолуолОтвет: 4

Установите соответствие между названием вещества и продуктами его гидролизаА) метилат калияБ) хлорид фосфора (V)В) метилацетатГ) сульфид алюминияОтвет: 6254

Литература : 1. Химия Типовые тестовые задания - 2013 г; Ю.Н. Медведев., Издательство «Экзамен» М.2013 г2. Химия Типовые экзаменационные варианты 2012 г; под редакцией А.А. Кавериной., М. «Национальное образование» 2011г.3. Химия -2012 ФИПИ ; Самое полное издание типовых вариантов заданий ЕГЭ; авторы составители: А.А. Каверина, Д.Ю. Доротин, А.С.Корощенко, М.Г. Снастина; М. АСТ Астрель. 2011г4. Химия -2011 ФИПИ ; Самое полное издание типовых вариантов заданий ЕГЭ; авторы составители: А.А. Каверина, Д.Ю. Доротин, А.С.Корощенко, М.Г. Снастина; М. АСТ Астрель. 2010 г;Химия; подготоовка к ЕГЭ -2011; учебно-методическое пособие под редакцией В.Н. Доронькина; Ростов-на-Дону Легион 2010 гХимия Тренировочные задания ; П.А. Оржековский, В.Ю. Мишина, Л.И. Пашкова и др.; М Эксмо 2012 гОрганическая химия , А.А. Петров, Х.В. Бальян, А.Т. Трощенко, М. Высшая школа 1981

Интернет- источники:Картинки:1.http://ru.wikipedia.org/wiki/%D0%9A%D0%B0%D1%80%D0%B1%D0%BE%D0%BD%D0%BE%D0%B2%D1%8B%D0%B5_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D1%8B2. http://chemistry.komschool-2.spb.ru/5.htm3. http://improvehealth.ru/item/muravinaya-i-uksusnaya-kislota-ikh-primenenie-v-meditsine-1268.html4. http://www.chemistry.ssu.samara.ru/chem4/index4.htm






CH3CHO + H2O CH3COOH +4[H] (кат) CH3CH2OH+H2O2. Реакции замещения:СН3СООН + CL2(PCL5) CH2CL-COOH +HCL3. Реакция этерификации:СH3-COOH + CH3OH CH3-C… Специфические свойства карбоновых кислот:Восстанавливаются до альдегидов и спиртов: CH3COOH +2[H](кат)CH3CHO + H2O CH3COOH +4[H] (кат) CH3CH2OH+H2O2. Реакции замещения:СН3СООН + CL2(PCL5) CH2CL-COOH +HCL3. Реакция этерификации:СH3-COOH + CH3OH CH3-C…](/images/8/18934/640/img7.jpg)

![Специфические свойства муравьиной кислоты:По карбонильной группе А) реакция серебряного зеркала.HCOOH+2[Ag(NH3)2]OH2Ag+CO2+H2O+4NH3Б) реакция с гидроксидом меди (II).HCOOH+2Cu(OH)2 CO2+Cu2O+H2O2. разложение:HCOOH(H2SO4k)CO+H2O3. Окисление хлором:HCO… Специфические свойства муравьиной кислоты:По карбонильной группе А) реакция серебряного зеркала.HCOOH+2[Ag(NH3)2]OH2Ag+CO2+H2O+4NH3Б) реакция с гидроксидом меди (II).HCOOH+2Cu(OH)2 CO2+Cu2O+H2O2. разложение:HCOOH(H2SO4k)CO+H2O3. Окисление хлором:HCO…](/images/8/18934/640/img9.jpg)
![Получение:Окисление альдегидов и первичных спиртов:CH3CHO + [O]CH3COOHCH3CH2-OH+ [O] CH3COOH2. Гидролиз галогенозамещенных углеводородов, содержащих три атома галогена у одного атома углерода:СH3-CCL3 + 3NaOHCH3-COOH +3NaCL3. Гидролиз сложных эфиров… Получение:Окисление альдегидов и первичных спиртов:CH3CHO + [O]CH3COOHCH3CH2-OH+ [O] CH3COOH2. Гидролиз галогенозамещенных углеводородов, содержащих три атома галогена у одного атома углерода:СH3-CCL3 + 3NaOHCH3-COOH +3NaCL3. Гидролиз сложных эфиров…](/images/8/18934/640/img10.jpg)













































