Презентация на тему: Решение олимпиадных задач по химии

Методы решения олимпиадных задач по химии 900igr.net

Массовые доли и Закон эквивалентов

Районная олимпиада 2000 г. 9 класс При обжиге сульфида трехвалентного металла массой 22,5 г было израсходовано 15,12 л (н.у.) кислорода. Полученный газ был окислен в присутствии катализатора, продукт этой реакции растворен в воде и полностью нейтрализован раствором гидроксида натрия. Определите: а) Какой объем 22%-ного раствора гидроксида натрия (плотность 1,24) потребуется для полной нейтрализации водного раствора продукта каталитического окисления? б) Сульфид какого металла подвергался обжигу?

Решение Обозначим неизвестный металл – М, тогда 2Me2S3 + 9O2 = 6SO2 + 2Me2O3 2SO2 + O2 = 2SO3 SO3 + H2O = H2SO4 Следовательно, Me2S3 3H2SO4 Находим атомную массу металла: (2А+96) г Me2S3 — 4,5 22,4 л O2 22,5 г Me2S3 — 15,12 л O2. Отсюда 2А = 22,5(г) 4,5(г) 22,4(л):15,12(л)–96 , А=27, это – алюминий.

Решение (продолжение) Al2S3 + 4,5O2 = 3SO2 + Al2O3 150 г Al2S3 — 3 98 г H2SO4 22,5 г Al2S3 — m г H2SO4 Отсюда m(H2SO4)=22,5(г) 3 98(г):150(г)=44,1 г H2SO4 + 2NaOH = Na2SO4 + H2O 80 г NaOH — 98 г H2SO4 m(NaOH) — 44,1 г H2SO4 Отсюда m(NaOH)=44,1(г) 80(г):98(г)=36 г, mраствора(NaOH)=36(г):0,22=163,64(г), Vраствора(NaOH)=163,64(г):1,24(г/мл)=132(мл).

Санкт-Петербургская олимпиада 2000 г. 9 класс При взаимодействии 3,57 г галогенида щелочного металла с избытком раствора нитрата серебра образовалось 5,64 г осадка. Если такую же навеску галогенида обработать концентрированной серной кислотой с последующим прокаливанием продукта реакции, то получается 2,61 г сухого остатка. Определите состав галогенида щелочного металла.

Решение Первую реакцию можно представить в виде: MHal + AgNO3 = AgHal + MNO3 Пусть молярная масса галогенида металла равна (А+х) г/моль, тогда молярная масса галогенида серебра равна (108+х) г/моль. Отсюда (A+x)/3,57 = (108+x)/5,64 или 5,64A + 2,07x = 385,56 Вторая реакция: 2MHal + H2SO4 = M2SO4 + 2HHal Отсюда 2(A+x)/3,57 = (2A+96)/2,61 или 5,22х – 1,92А = 342,72 Решая эти два уравнения, получим А=39 (калий), х=80 (бром). Следовательно в качестве исходного соединения был взят бромид калия.

Массовая доля, ω Массовая доля - отношение массы элемента (группы элементов), входящего в соединение, к общей массе соединения XxYyZz ωX = mсоед mX ωZ = mсоед mZ ωY = mсоед mY

Массовая доля, ω Аргентит Ag2S Серебро Сера

Массовая доля, ω XxYyZz ωX = Mсоед xMX ωZ = Mсоед zMZ ωY = Mсоед yMY Аргентит:
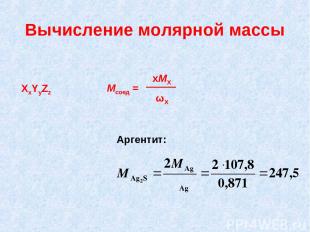
Вычисление молярной массы XxYyZz ωX Mсоед = xMX Аргентит:

Определение индексов в формулах XxYyZz x:y:z = ωX MX : ωY MY : ωZ MZ Аргентит (AgxSy):

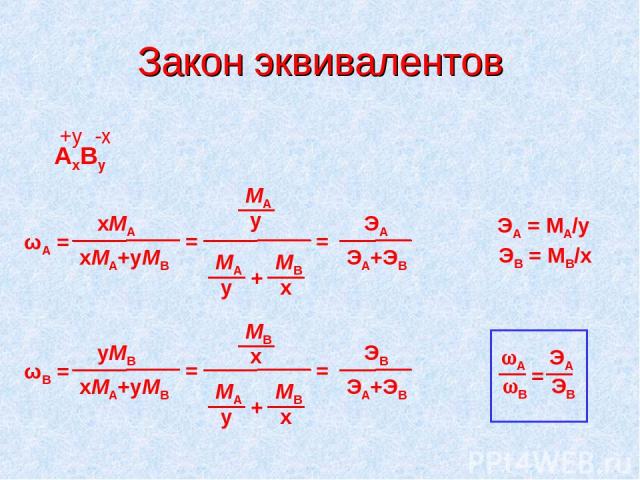
Закон эквивалентов Иеремия Вениамин РИХТЕР (1762 – 1807) «Если одно и то же количество какой-либо кислоты нейтрализуется различными количествами двух или большего числа оснований, то количества последних эквивалентьны и нейтрализуются одним и тем же количеством другой кислоты И.В.Рихтер (1792) Современная формулировка Элементы соединяются между собой в весовых отношениях пропорциональных их химическим эквивалентам. AxBy +y -x wA ЭА wВ ЭВ = ЭА = МА/y ЭВ = МВ/x
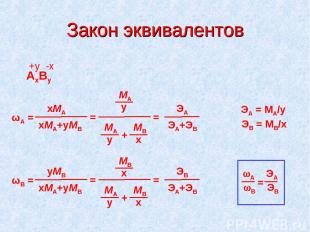
Закон эквивалентов AxBy +y -x wA ЭА wВ ЭВ = ЭА = МА/y ЭВ = МВ/x ωA = xMA+yMB xMA = MA = y MA y MВ х + ЭA+ЭB ЭA ωВ = xMA+yMB yMВ = MB = x MA y MВ х + ЭA+ЭB ЭB

Вопрос из теста по химии галогенов (Химцентр, 9 класс) Минерал гессит содержит 37,2% теллура. Определите формулу гессита.

Решение Предположим, что гессит содержит только один атом теллура. Тогда молярная масса минерала будет равна: М = А(Те)/ω(Те) = 127,6/0,372 = 343 г/моль. (Если в молекуле присутствует 2, 3, 4 и т.д. атомов теллура, то молярная масса возрастает в соответствующее число раз). В принципе минерал может быть теллуридом, теллуритом или теллуратом какого-то металла. Необходимо проанализировать все случаи. Если минерал является теллуридом, то на входящий в него металл приходится 343 – 127,6 = 215,6 г/моль. Эта величина точно соответствует удвоенной атомной массе серебра (107,8×2). Следовательно, гессит – это теллурид серебра Ag2Te. (Анализ теллуритов и теллуратов не дает разумных структур).

Районная олимпиада 2001 г. 10 класс Хлорпроизводное некоторого углеводорода содержит 63,89% хлора и 32,47% углерода. Определите простейшую формулу этого соединения. Напишите структурные формулы двух его изомеров, принадлежащих к разным гомологическим рядам.

Решение В соединении содержится 100 – (63,89 + 32,47) = 3,64% водорода. Мольное отношение элементов в соединении будет равно: (C): (H): (Cl) = = 2.7:3.6:1,8 = 3:4:2. Простейшая формула: C3H4Cl2. Возможные структурные формулы: СH2=CH–CHCl2 Cl Cl

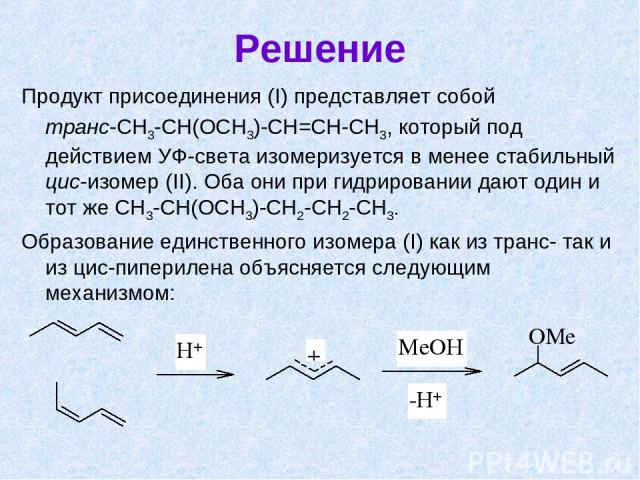
Санкт-Петербургская олимпиада 2001 г. 11 класс Известно, что технический пиперилен представляет собой смесь 40% цис- и 60% транс-пентадиена-1,3. А.В.Воронков показал, что при нагревании смеси технического пиперилена и метанола при 90 С и 5 атм в присутствии кислого сульфоионитного катализатора образуется единственный продукт (I), содержащий по данным анализа 71,96% С, 12,07% Н и 15,97% О. При ультрафиолетовом освещении (I) может изомеризоваться в (II), причем оба изомера при каталитическом гидрировании легко образуют один и тот же продукт (III). Установите строение всех обозначенных цифрами соединений. Объясните, почему при реакции смеси изомеров пиперилена образуется единственный изомер (I).

Решение В продукте (I) С: Н: О = 71,96/12,01):(12,07/1,01):(15,97/16,00) 6:12:1. Следовательно, молекулярная формула продукта (I) ‒ С6Н12О. Такой молекулярной формулой может обладать продукт присоединения метанола к пиперилену. Реакция, в принципе, может осуществляться по трем направлениям: СН3-СН=СН-СН=СН2 + СН3ОН = СН3-СН=СН-СН(ОСН3)-СН3 СН3-СН=СН-СН=СН2 + СН3ОН = СН3-СН2-СН(ОСН3)-СН=СН2 СН3-СН=СН-СН=СН2 + СН3ОН = СН3-СН(ОСН3)-СН=СН-СН3 В первой реакции (1,2-присоединение) не затрагивается 3-двойная связь, следовательно, должна образовываться смесь цис- и транс-изомеров. Во второй реакции образуется терминальный алкен, который не может изомеризоваться под действием УФ-света. Следовательно, осуществляется 1,4-присоединение (3 реакция).
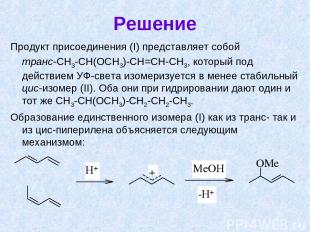
Решение Продукт присоединения (I) представляет собой транс-СН3-СН(ОСН3)-СН=СН-СН3, который под действием УФ-света изомеризуется в менее стабильный цис-изомер (II). Оба они при гидрировании дают один и тот же СН3-СН(ОСН3)-СН2-СН2-СН3. Образование единственного изомера (I) как из транс- так и из цис-пиперилена объясняется следующим механизмом:

Санкт-Петербургская олимпиада 2000 г. 9 класс Неизвестный металл при нагревании активно реагирует с хлором, образуя хлорид с содержанием металла 25,2% по массе. Хлорид этого металла при обычных условиях жидкость и реагирует с водой. а) Определите неизвестный металл и напишите формулу его хлорида. б) Напишите уравнения описанных в условии задачи реакций. в) Где может применяться свойство хлорида этого металла реагировать с водой.

Решение Определим эквивалентную массу металла: 25,2 (г) Ме — 74,8 (г) Cl Э(Ме) — 35,5 (г) Cl Отсюда Э(Ме) = 25,2 35,5/74,8 = 11,96 12 (г) Валентность Атомная масса 1 12 (углерод, но он не подходит по условиям задачи) 2 24 (магний, но его хлорид – твердое вещество)) 3 36 (нет) 4 48 (титан) Ti + 2Cl2 = TiCl4 – жидкость, легко гидролизуется; TiCl4 + 4H2O = Ti(OH)4 + 4HCl Это свойство применяется для постановки дымовых завес, т.е. при разбрызгивании TiCl4 образуется густой туман.

Российская олимпиада 2001 г. 9 класс Открыт в l801 г. Ч. Хатчеттом (Лондон, Англия). БЕРЦЕЛИУС ВЁЛЕРУ. Посылаю тебе при этом обратно твой Х, который я вопрошал, как мог, но от которого получил лишь уклончивые ответы. "Ты титан?" спрашивал я. "Вёлер уже тебе сказал, что я не титан". Я также установил это. "Ты циркон?" "Нет, отвечал он, я же растворяюсь в соде до эмалево-белого стекла... чего не делает цирконовая земля". "Ты олово?" "Я содержу олово, но очень мало". "Ты .......?" "Я с ним родственен, отвечал он, но я постепенно растворяюсь в едком кали и осаждаюсь из него желто-коричневым". "Ну что же ты тогда за дьявольская вещь?" спросил я. "Мне еще не дали имени". Между прочим я не совсем уверен, действительно ли я это слышал, потому что он был по правую сторону от меня, а я плохо слышу на правое ухо. Так как твой слух, по-видимому, гораздо лучше моего, то я шлю тебе этого сорванца, чтобы учинить ему новый допрос".

продолжение ВЁЛЕР БЕРЦЕЛИУСУ "Относительно второго ......., о котором ты мне писал, когда я занимался пирохлором, действительно, твоя правда. Я не печалюсь о том, что он от меня ускользнул, и от души радуюсь открытию славного Генриха". 1. Что исследовали Берцелиус и Вёлер (Х), если Х содержит 30,1% кислорода? 2. Что такое циркон и "цирконовая земля"? 3. С чем родственен Х (......)? 4. Попробуйте записать реакции растворения в едком кали Х и осаждения. 5. Что содержит "пирохлор", из которого Вёлер выделял Х, и почему он так называется? 6. Кто такой "славный Генрих", что он открыл?

Решение Берцелиус и Вёлер исследовали некую «землю», т.е. оксид металла. Его эквивалентная масса равна: Э(М) = (100 – 30,1)•8:30,1 = 18,58. При степени окисления 5 молярная масса металла равна 92,9. Это – ниобий. Оксид ниобия (Nb2O5). Циркон – минерал ZrSiO4. «Цирконова земля» – ZrO2. С танталом (в данном случае с Та2O5). 6KOH + Nb2O5 = 2K3NbO4 + 3H2O (сплавление) 2K3NbO4 + 6HCl = 6KCl + Nb2O5↓ + 3H2O Минерал M(Nb,Ta)2O6, где М – Ca, Fe, Mn. При нагревании приобретает зеленую окраску (отсюда и название). «Славный Генрих» - Генрих Розе (1795 – 1864), немецкий химик, ученик Берцелиуса. Независимо от Ч. Хатчетта открыл (1844) в минерале колумбите элемент (в виде окиси), близкий по свойствам к танталу и названный им ниобием. Доказал, что ниобий и тантал являются различными элементами.

Санкт-Петербургская олимпиада 2000 г. 9 класс Простое вещество А массой 0,624 г растворили в щелочи. При этом выделился 1 л газа, для окисления которого потребовался 1 л хлора. Через полученный раствор пропустили углекислый газ до полного выпадения осадка, который отфильтровали и прокалили. Масса остатка оказалась равной 1,34 г. Определите вещество А и напишите уравнения упомянутых реакций. (Объемы газов измерены при н.у.).

Решение При взаимодействии вещества А со щелочью могут выделяться: а) водород (Al + NaOH). б) кислород (F2 + NaOH). в) соединение А с водородом (P + NaOH). Из соотношения объемов выделившегося газа и хлора следует, что этот газ – водород. При пропускании в раствор СО2 может выпадать карбонат или гидроксид. Оба они при прокаливании могут образовать оксид. По навеске исходного простого вещества и массе оксида находим эквивалентную массу вещества А: Э(А) = 0,624 8:(1,34–0,624) = 6,97.

Решение Вещество А не может быть литием, т.к. его карбонат заметно растворим в воде, и азотом, т.к. он не реагирует с щелочью. Условию задачи удовлетворяет кремний (Аr = 28). Уравнения реакций: Si + 2NaOH + H2O = Na2SiO3 + H2 . H2 + Cl2 = 2HCl. Na2SiO3 + CO2 + H2O = H2SiO3 + Na2CO3. H2SiO3 = H2O + SiO2.

Санкт-Петербургская олимпиада 2000 г. 9 класс Монету чеканки 1992 года, достоинством 1 рубль и массой 3,28 г опустили в раствор соляной кислоты. При этом выделилось 1,2 л водорода (н.у.) и осталось 0,28 г нерастворившегося остатка. Этот остаток обработали разбавленной азотной кислотой и получили раствор голубого цвета. а) Определите, какой металл является основным компонентом монеты. б) Обсудите состав нерастворимого в соляной кислоте вещества. в) Для чего служит это второе вещество?

Решение Масса основного компонента монеты: 3,28 – 0,28 = 3,00 (г) 3 (г) выделяют из кислоты 1,2 (л) водорода, а 1 экв – 11,2 (л), тогда ЭМе = 3 (г) 11,2 (л)/1,2 (л) = 28 (г). Атомная масса металла: Валентность Атомная масса 1 28 (нет) 2 56 (железо) 3 84 (нет) 4 112 (кадмий, но у него нет валентности 4) Вторым компонентом сплава является медь, на что указывает цвет раствора после реакции с азотной кислотой. Уравнения реакций: Fe + 2HCl = FeCl2 + H2 , 3Cu + 8HNO3 = 3Cu(NO3)3 + 2NO + 4H2O Медь вводят в состав монеты для придания ей привычного желтоватого оттенка.

Санкт-Петербургская олимпиада 2000 г. 9 класс Химическое соединение, содержащее 92,83% элемента Х, поместили в стакан и добавили 100 г раствора азотной кислоты. После окончания реакции остаток отфильтровали и получили чистый 12,00%-ный раствор нитрата Х. При добавлении 10 мл этого раствора к 100 мл раствора сульфата аммония выпадает осадок, в котором содержание Х на 24,5% меньше, чем в исходном веществе. При добавлении 10 мл этого раствора к 100 мл раствора аммиака выпадает осадок, в котором содержание Х только на 7% меньше, чем в исходном веществе. 1. Предложите максимально простой, но обоснованный способ однозначного определения Х. 2. Рассчитайте массовую долю HNO3 в растворе азотной кислоты.

Решение Очевидно, что Х – это некоторый металл. Рассчитаем эквивалентную массу Х, исходя из его массовой доли в образовавшемся сульфате. Массовая доля Х в сульфате равна 92,83–24,5=68,33; отсюда: Э(Х)/Э(SO4) = 68,33/(100–68,33). Э(Х) = 103,6. Элемент Х – это свинец. Представим исходное соединение в виде PbnYm, где Y–произвольная группа атомов. Определим Э(Y): Э(Y)/Э(Pb)=(100–92,83)/92,83. Отсюда Э(Y) = 8. Очевидно, что Y – это кислород. При добавлении к PbO азотной кислоты прошла реакция: PbO + 2HNO3 = Pb(NO3)2 + H2O Обозначим через х массовую долю азотной кислоты, тогда (HNO3)=x/63, a (PbO)= (Pb(NO3)2)=x/126. Отсюда m(PbO) = 1,771x a m(Pb(NO3)2)=2,629x. Масса полученного раствора равна 100+1,771х, а концентрация Pb(NO3)2 = 2,629/(100+1,771х) = 0,1200. Отсюда х = 4,967%.
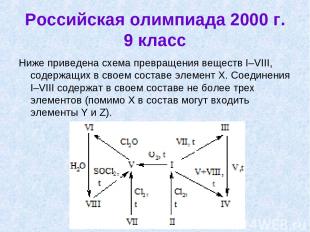
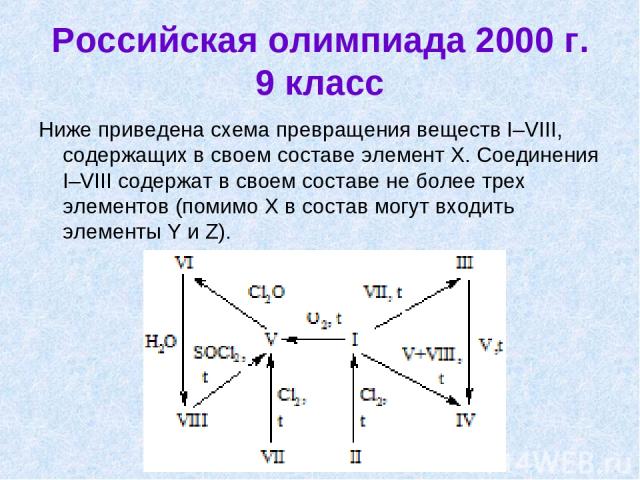
Российская олимпиада 2000 г. 9 класс Ниже приведена схема превращения веществ I–VIII, содержащих в своем составе элемент Х. Соединения I–VIII содержат в своем составе не более трех элементов (помимо Х в состав могут входить элементы Y и Z).
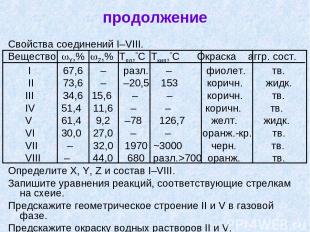
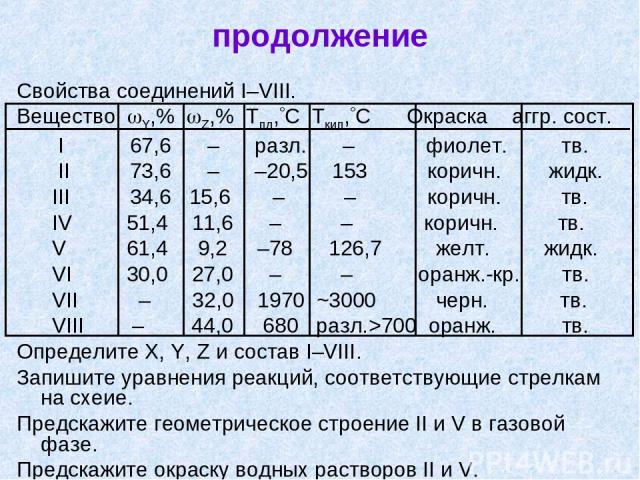
продолжение Свойства соединений I–VIII. Вещество Y,% Z,% Тпл, С Ткип, С Окраска аггр. сост. I 67,6 – разл. – фиолет. тв. II 73,6 – –20,5 153 коричн. жидк. III 34,6 15,6 – – коричн. тв. IV 51,4 11,6 – – коричн. тв. V 61,4 9,2 –78 126,7 желт. жидк. VI 30,0 27,0 – – оранж.-кр. тв. VII – 32,0 1970 ~3000 черн. тв. VIII – 44,0 680 разл.>700 оранж. тв. Определите X, Y, Z и состав I–VIII. Запишите уравнения реакций, соответствующие стрелкам на схеие. Предскажите геометрическое строение II и V в газовой фазе. Предскажите окраску водных растворов II и V.

Решение Из схемы превращений и таблицы составов следует, что переходы I→II (хлорирование) и VII→V (хлорирование) приводит к увеличению содержания Y, т.е. Y может быть хлором. Переход I→V (окисление кислородом) приводит к появлению в составе соединения Z, тогда Z может быть кислородом. В таком случае: I, II – хлориды, X, III – VI – оксохлориды, X, VII – VIII – оксиды Х. Исходя из состава хлорида XCln, можно определить Х: Для I 67,6 – 32,4 35,45 – ? ? = 16,99; при n = 3 Ar(X) = 50,97 – V Для II 73,6 – 26,4 35,45 – ? ? = 12,7; при n = 4 Ar(X) = 50,9 – V Тетрахлорид ванадия является жидкостью. Таким образом: X – V, Y – Cl, Z – O.
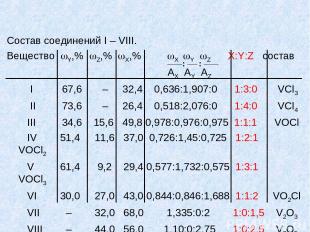
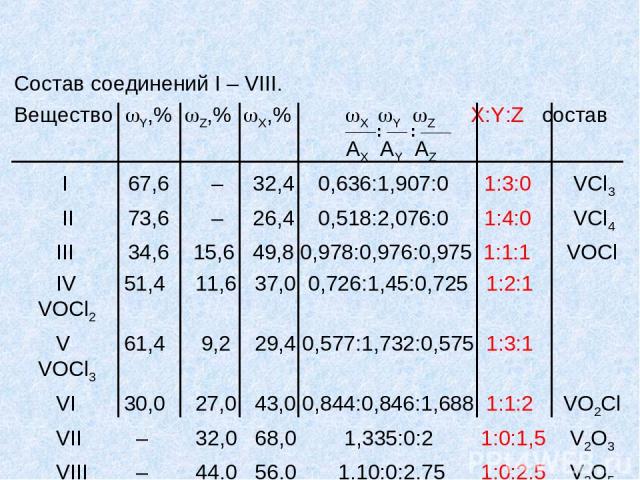
Состав соединений I – VIII. Вещество Y,% Z,% Х,% Х Y Z X:Y:Z состав AX AY AZ I 67,6 – 32,4 0,636:1,907:0 1:3:0 VCl3 II 73,6 – 26,4 0,518:2,076:0 1:4:0 VCl4 III 34,6 15,6 49,8 0,978:0,976:0,975 1:1:1 VOCl IV 51,4 11,6 37,0 0,726:1,45:0,725 1:2:1 VOCl2 V 61,4 9,2 29,4 0,577:1,732:0,575 1:3:1 VOCl3 VI 30,0 27,0 43,0 0,844:0,846:1,688 1:1:2 VO2Cl VII – 32,0 68,0 1,335:0:2 1:0:1,5 V2O3 VIII – 44,0 56,0 1,10:0:2,75 1:0:2,5 V2O5 : :

Решение Реакции 2VCl3 + Cl2 → 2VCl4 (I → II) VCl3 + V2O3 → 3VOCl (I → III) VCl3 + VOCl3 + V2O5 → 6VOCl2 (I → IV) VOCl + VOCl3 → 2VOCl2 (III → IV) 2VCl3 + O2 → 2VOCl3 (I → V) VOCl3 + Cl2O → VO2Cl + 2Cl2 (V → VI) 2V2O3 + 6Cl2 → 4VOCl3 (VII → V) 2VO2Cl + H2O → V2O5 + 2HCl (VI → VIII) V2O5 + 3SOCl2 → 2VOCl3 + 3SO2 (VIII → V)
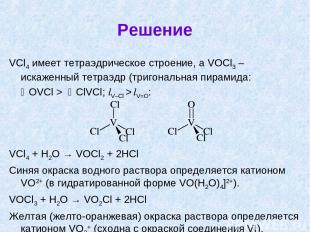
Решение VCl4 имеет тетраэдрическое строение, а VOCl3 – искаженный тетраэдр (тригональная пирамида: OVCl > ClVCl; lV–Cl > lV=O: VCl4 + H2O → VOCl2 + 2HCl Синяя окраска водного раствора определяется катионом VO2+ (в гидратированной форме VO(H2O)4]2+). VOCl3 + H2O → VO2Cl + 2HCl Желтая (желто-оранжевая) окраска раствора определяется катионом VO2+ (сходна с окраской соединения VI).

Санкт-Петербургская олимпиада 2001 г. 11 класс Изучая химию молибдена, Конрад Сеппелт осуществил взаимодействие MoCl5 с Zn(CH3)2 в пентане при –78 С. Через 30 мин он выделил бирюзовые игольчатые кристаллы, разлагающиеся при нагревании до –10 С или при контакте с кислородом воздуха. При нагревании 59,5 мг этих кристаллов в токе кислорода образуется 50,0 мг твердого белого вещества, содержащего 66,7% молибдена, а отходящие газы не дают осадка при пропускании через подкисленный раствор нитрата серебра. С помощью рентгеноструктурного анализа кристаллов установлено, что одна из связей молибдена короче других. Установите состав бирюзовых кристаллов, напишите уравнение синтеза. Каково пространственное строение образовавшегося соединения? Почему оно обладает высокой реакционной способностью и низкой устойчивостью?

Решение При нагревании бирюзовых кристаллов с кислородом в остатке, вероятнее всего, оказалось соединение молибдена, не содержащее углерода и водорода, т.е его хлорид, оксид или оксохлорид. Предположим, что это хлорид формулы MoClx, тогда 66,7/95,94 = 33,3/35,45x, откуда х=1,35, что маловероятно. Предположим, что это оксид формулы МоОх, тогда 66,7/95,94 = 33,3/16x, откуда х=3, т.е. образуется МоО3. (Оксохлориды можно не проверять). Т.к. ни остаток, ни отходящие газы не содержат хлора, то можно бирюзовые кристаллы содержат только Мо, С и Н. Можно предположить, что это металлорганическое соединение, содержащее метильные группы (из диметилцинка) типа Мо(СН3)n. В 50 мг МоО3 содержится 50 0,667 = 33,35 мг Мо. Столько же его содержится и в 59,5 мг кристаллов. На метильные группы приходится 59,5–33,35 = 26,15 мг. Отсюда 33,35/95,94=26,15/15,04n. Следовательно, n=5. Значит бирюзовые кристаллы имеют состав Мо(СН3)5.

Решение Уравнение их синтеза: 2MoCl5 + 5Zn(CH3)2 = 2Мо(СН3)5 + 5ZnCl2 Пять заместителей возле центрального атома могут располагаться либо в виде тригональной бипирамиды, либо в виде квадратной пирамиды. В первом случае две аксиальные связи должны отличаться от трех экваториальных. Во втором – только одна связь отличается от четырех других. Это и соответствует структуре молекулы пентаметилмолибдена. Молекула пентаметилмолибдена имеет нечетное число электронов, т.е. является радикалом, что определяет его высокую активность и низкую стабильность.


































![Решение VCl4 имеет тетраэдрическое строение, а VOCl3 – искаженный тетраэдр (тригональная пирамида: OVCl > ClVCl; lV–Cl > lV=O: VCl4 + H2O → VOCl2 + 2HCl Синяя окраска водного раствора определяется катионом VO2+ (в гидратированной форме VO(H2O)4]2+).… Решение VCl4 имеет тетраэдрическое строение, а VOCl3 – искаженный тетраэдр (тригональная пирамида: OVCl > ClVCl; lV–Cl > lV=O: VCl4 + H2O → VOCl2 + 2HCl Синяя окраска водного раствора определяется катионом VO2+ (в гидратированной форме VO(H2O)4]2+).…](https://fs3.ppt4web.ru/images/132073/183863/640/img38.jpg)