Презентация на тему: Реакция гидролиза солей

Гидролиз солей. Единственный путь, Ведущий к знанию,- Это деятельность. «Шоу» Составила Громова Ольга Ильинична, учитель химии и биологии «МОУ Лямбирская СОШ № 1» 900igr.net Громова О.И

Гидроксиды NaOH, KOH, NH4OH, Cu(OH)2, Zn(OH)2, Al(OH)3, H2SO4, HNO3, HClO4, HCl, HMnO4, HI, HBr, H2SO3, H2CO3, H2SiO3, HF, HNO2 Громова О.И

* Громова О.И * Электролиты сильные: NaOH, KOH, H2SO4, HNO3, HClO4, HCl, HMnO4, HI, HBr; слабые: , NH4OH, Cu(OH)2, Zn(OH)2, Al(OH)3, H2SO3, H2CO3, H2SiO3, HF, HNO2, СН3СООН Громова О.И
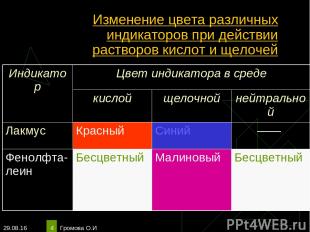
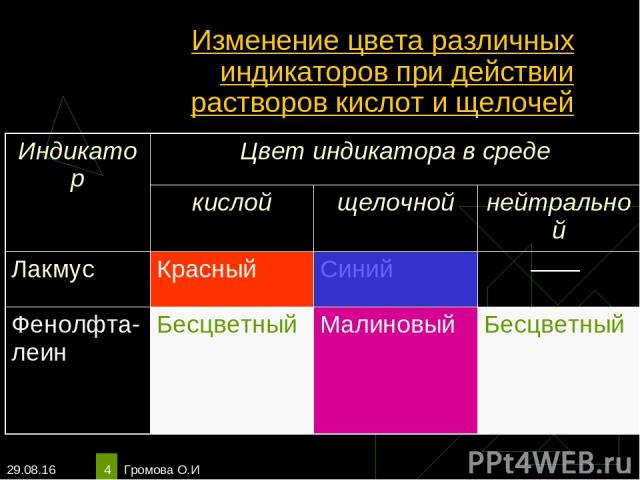
* Громова О.И * Изменение цвета различных индикаторов при действии растворов кислот и щелочей Индикатор Цвет индикатора в среде кислой щелочной нейтральной Лакмус Красный Синий —— Фенолфта-леин Бесцветный Малиновый Бесцветный Громова О.И

* Громова О.И * Любую соль можно представить как продукт взаимодействия основания с кислотой. В зависимости от силы основания и кислоты можно выделить 4 типа солей: Громова О.И

* Громова О.И * 1.Соли, образованные сильной кислотой и слабым основанием (AlCl3, FeSO4, Mn(NO3)2.) 2. Соли, образованные сильным основанием и слабой кислотой (Na2CO3, КСN, NaCH3COO). 3. Соли, образованные слабой кислотой и слабым основанием (NH4CN, Cu(CH3COO)2). 4. Соли, образованные сильной кислотой и сильным основанием (NaCl, K2SO4, BaI2). Громова О.И

* Громова О.И * Гидролизом называется взаимодействие веществ с водой, при котором составные части вещества соединяются с составными частями воды. Гидролизу подвержены соединения различных классов. Рассмотрим один случай – гидролиз солей. Громова О.И
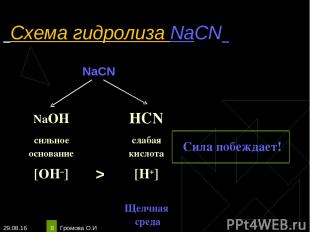
* Громова О.И * Схема гидролиза NaCN NaCN NaOH HCN сильное основание слабая кислота Сила побеждает! [OH–] > [H+] Щелчная среда Громова О.И

* Громова О.И * Уравнения гидролиза NaCN NaCN ↔Na+ + CN‾ Н2О ↔ OH ‾ + H+ ____________________________ Полное ионное уравнение гидролиза: Na+ + CN¯ + Н2О ↔ Na+ + OH¯ + HCN Сокращённое уравнение гидролиза: CN¯ + Н2О ↔ OH¯ + HCN Полное молекулярное уравнение гидролиза: NaCN + Н2О ↔ NaOH + HCN Избыток гидроксид-ионов дает соли щелочную среду, поэтому лакмус синеет, а фенолфталеин становится малиновым. рн >7, среда щелочная, гидролиз по аниону. Громова О.И
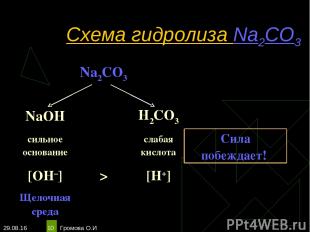
* Громова О.И * Схема гидролиза Na2CO3 Na2CO3 NaOH H2CO3 сильное основание слабая кислота Сила побеждает! [OH–] > [H+] Щелочная среда Громова О.И

* Громова О.И * Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ Полное ионное уравнение гидролиза: 2Na+ + СO32– + Н2O ↔ 2Na+ + HCO3– + ОН– Сокращённое уравнение гидролиза: СO32– + Н2O ↔ НСO3– + ОН– Полное молекулярное уравнение гидролиза: Na2CO3 + Н2O ↔ 2NaHCO3 + NaОН Избыток гидроксид-ионов дает соли щелочную среду, поэтому лакмус синеет, а фенолфталеин становится малиновым. рн >7, среда щелочная, гидролиз по аниону. Громова О.И
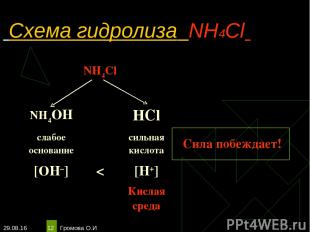
* Громова О.И * Схема гидролиза NH4Cl NH4Cl NH4OH HCl слабое основание сильная кислота Сила побеждает! [OH–] < [H+] Кислая среда Громова О.И

* Громова О.И * Уравнения гидролиза NH4Cl NH4Cl ↔ NH4+ + Сl– Н2O ↔ Н+ + ОН– _________________________________________ Полное ионное уравнение гидролиза: NH4+ + Сl– + Н2O ↔ NH3·H2О + Сl– + Н+ Сокращённое уравнение гидролиза: NH4+ + Н2O ↔ NH3·H2О + Н+ Полное молекулярное уравнение гидролиза: NH4Cl + Н2O ↔ NH3·H2О + НСl Избыток ионов водорода дает соли кислую среду, поэтому лакмус краснеет. рн < 7, среда кислотная, гидролиз по катиону. Громова О.И
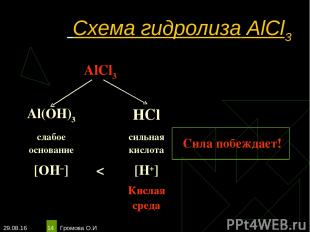
* Громова О.И * Схема гидролиза AlCl3 AlCl3 Al(OH)3 HCl слабое основание сильная кислота Сила побеждает! [OH–] < [H+] Кислая среда Громова О.И

* Громова О.И * Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– ______________________________________ Полное ионное уравнение гидролиза: Al3+ + 3Сl– + Н2O ↔ АlOН2+ + 3Сl– + Н+ Сокращённое уравнение гидролиза: Аl3+ + Н2O ↔ АlOН2+ + Н+ Полное молекулярное уравнение гидролиза: АlСl3 + Н2O ↔ АlOНСl + НСl Избыток ионов водорода дает соли кислую среду, поэтому лакмус краснеет. рн < 7, среда кислотная, гидролиз по катиону. Громова О.И
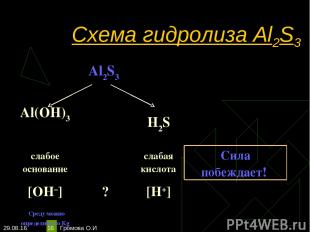
* Громова О.И * Схема гидролиза Al2S3 Al2S3 Al(OH)3 H2S слабое основание слабая кислота Сила побеждает! [OH–] ? [H+] Среду можно определить по Кg Громова О.И

* Громова О.И * Уравнения гидролиза Al2S3 Al2S3 + 6H2O-->2Al(OH)3 + 3H2S Гидролиз по катиону и аниону. Громова О.И
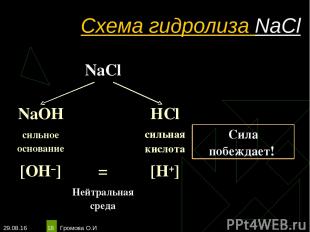
* Громова О.И * Схема гидролиза NaCl NaCl NaOH HCl сильное основание сильная кислота Сила побеждает! [OH–] = [H+] Нейтральная среда Громова О.И

* Громова О.И * Уравнения гидролиза NaCl NaCl ↔ Na+ + Сl– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ Na+ + Сl– + Н2O ↔ Na+ + Cl– + H2O Одинаковое количество гидроксид-ионов и ионов водорода дает соли нейтральную среду, поэтому индикаторы не меняют окраску (гидролизу не подвергается). рн =7, среда нейтральная, гидролиз не происходит. Громова О.И

* Громова О.И * Выполните следующие задания Какую среду будут иметь водные растворы следующих солей: 1 вариант 2 вариант а) нитрата цинка (II) а) хлорида меди (II) б) сульфата калия б) сульфита натрия в) сульфида натрия в) нитрата бария Составьте ионное уравнение гидролиза этих солей. Громова О.И

* Громова О.И * Ответы Громова О.И

* Громова О.И * Zn(NO3)2 ↔ Zn2+ + 2NO3– Н2O ↔ Н+ + ОН – ________________________________________________________ Zn2+ + 2NO3– + Н2O ↔ ZnOН+ + 2NO3– + Н+ Zn2+ + Н2O ↔ ZnOН+ + Н+ (среда кислая) Zn(NO3)2 + Н2O ↔ ZnOНNO3 + НNO3 2 вариант CuCl2 ↔ Cu2+ + 2Сl – Н2O ↔ Н+ + ОН – _______________________________________________________________________________________________________________________ Cu2+ + Сl – + Н2O ↔ CuOH+ + Cl – + Н+ Сu2+ + Н2O ↔ СuOH+ + Н+ (среда кислая) CuCl2 + Н2O ↔ CuOHCl + НCl а) 1 вариант Громова О.И
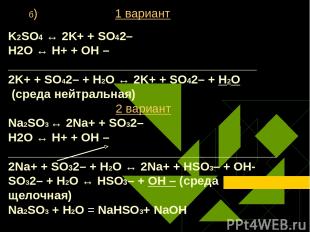
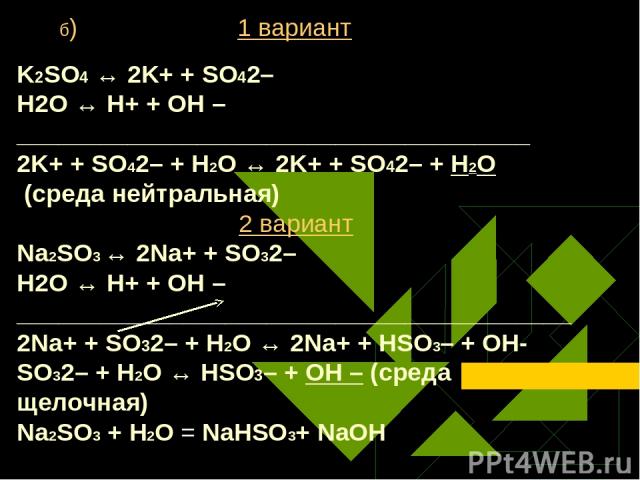
б) 1 вариант K2SO4 ↔ 2K+ + SO42– Н2O ↔ Н+ + ОН – _____________________________________ 2K+ + SO42– + Н2O ↔ 2K+ + SO42– + H2O (среда нейтральная) 2 вариант Na2SO3 ↔ 2Na+ + SO32– Н2O ↔ Н+ + ОН – ________________________________________2Na+ + SO32– + Н2O ↔ 2Na+ + HSO3– + ОН- SO32– + Н2O ↔ НSO3– + ОН – (среда щелочная) Na2SO3 + Н2O = NaHSO3+ NaОН Громова О.И

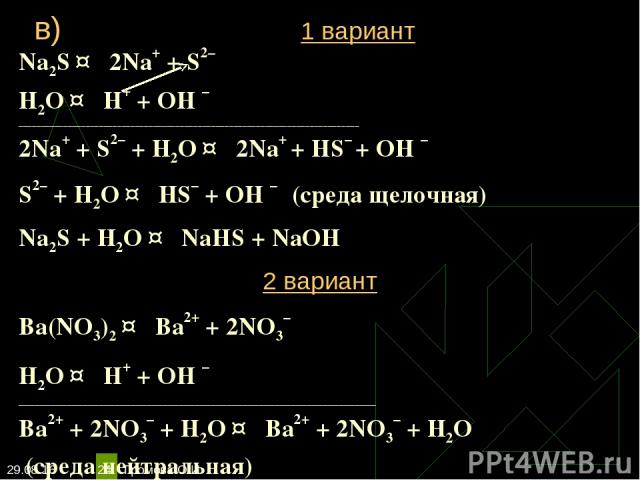
* Громова О.И * Na2S ↔ 2Na+ + S2– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2Na+ + S2– + Н2O ↔ 2Na+ + HS– + ОН – S2– + Н2O ↔ НS– + ОН – (среда щелочная) Na2S + Н2O ↔ NaHS + NaОН 2 вариант Ba(NO3)2 ↔ Ba2+ + 2NO3– Н2O ↔ Н+ + ОН – ___________________________________________________________________ Ba2+ + 2NO3– + Н2O ↔ Ba2+ + 2NO3– + Н2O (среда нейтральная) в) 1 вариант Громова О.И

* Громова О.И * Задания ЕГЭ Задания А-26 (ЕГЭ) 1.Кислую среду имеет водный раствор: Na3PO4 KCl Na2CO3 ZnSO4 2.Кислую среду имеет раствор: Нитрата меди (II) Нитрата бария Ацетата калия Карбоната натрия 3.Кислую реакцию среды имеет каждый из двух растворов: CuSO4 и BaCl2 Fe(NO3)3 и FeCl2 K3PO4 и NaCl Al(NO3)3 и CaCl2 4Кислую реакцию среды имеет каждый из двух растворов: BaCl2 и ZnCl2 AlCl3 и FeCl2 FeCl3 и NaCl KCl и CaCl2 5.Щелочную среду имеет водный раствор: FeCl3 K2SO4 Na2CO3 BaCl2 6.Фенолфталеин приобретает малиновую окраску в растворе каждой из двух солей: Сульфата меди (II) и сульфида натрия Хлорида калия и хлорида аммония Карбоната натрия и силиката калия Нитрата бария и хлорида железа (II) 7.Одинаковую реакцию среды имеют растворы карбоната натрия и нитрата бария силиката калия сульфата натрия хлорида алюминия 8.Соль, образованная сильным основанием и сильной кислотой, Гидролизуется по катиону Гидролизуется по аниону Не подвергается гидролизу Полностью разлагается водой Громова О.И

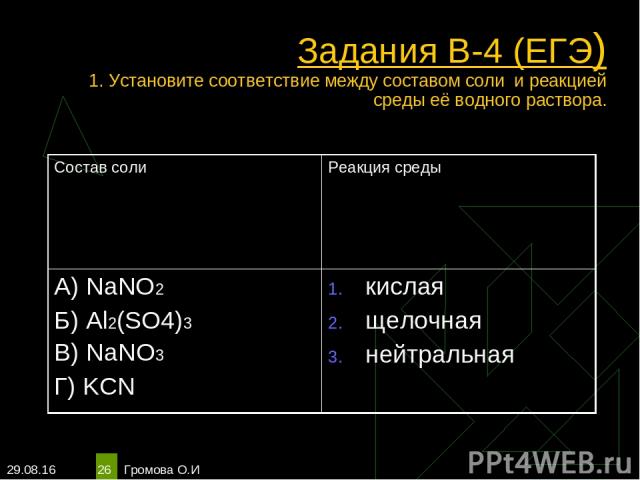
* Громова О.И * Задания В-4 (ЕГЭ) 1. Установите соответствие между составом соли и реакцией среды её водного раствора. Состав соли Реакция среды А) NaNO2 Б) Al2(SO4)3 В) NaNO3 Г) KCN кислая щелочная нейтральная Громова О.И

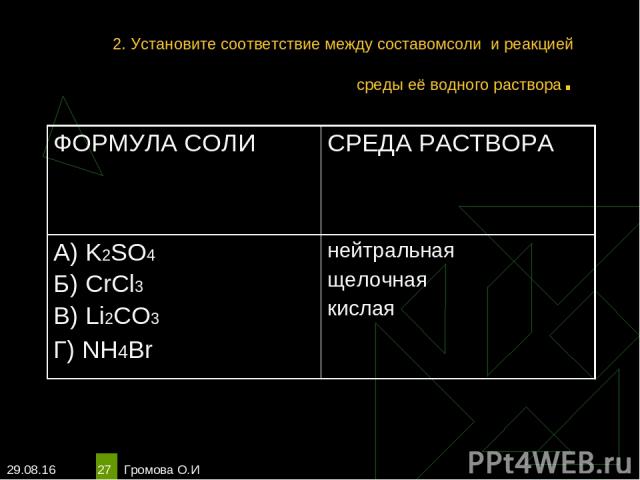
* Громова О.И * 2. Установите соответствие между составомсоли и реакцией среды её водного раствора. ФОРМУЛА СОЛИ СРЕДА РАСТВОРА А) K2SO4 Б) CrCl3 В) Li2CO3 Г) NH4Br нейтральная щелочная кислая Громова О.И

* Громова О.И * 3. Установите соответствие между названием соли и средой её водного раствора. Название соли Среда раствора А) нитрат свинца (Pb(NO3)2) Б) карбонат калия (K2CO3) В) нитрат натрия (NaNO3) Г) сульфид лития (Li2S) кислая щелочная нейтральная Громова О.И

* Громова О.И * Задние на дом: Параграф 18, № 1-11. В контакте. Ru, в заметках, материал ЕГЭ выполнить. Громова О.И

* Громова О.И * Источники материалов Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. — М.: Экзамен, 2001. Хомченко Г.П. , Хомченко И.Г. Сборник задач по химии. — М., 2000 . http://hydorlysis.narod.ru/pages/teoria.htm http://www.xumuk.ru/encyklopedia/1047.html Громова О.И







![* Громова О.И * Схема гидролиза NaCN NaCN NaOH HCN сильное основание слабая кислота Сила побеждает! [OH–] > [H+] Щелчная среда Громова О.И * Громова О.И * Схема гидролиза NaCN NaCN NaOH HCN сильное основание слабая кислота Сила побеждает! [OH–] > [H+] Щелчная среда Громова О.И](https://fs3.ppt4web.ru/images/132073/183857/640/img7.jpg)

![* Громова О.И * Схема гидролиза Na2CO3 Na2CO3 NaOH H2CO3 сильное основание слабая кислота Сила побеждает! [OH–] > [H+] Щелочная среда Громова О.И * Громова О.И * Схема гидролиза Na2CO3 Na2CO3 NaOH H2CO3 сильное основание слабая кислота Сила побеждает! [OH–] > [H+] Щелочная среда Громова О.И](https://fs3.ppt4web.ru/images/132073/183857/640/img9.jpg)

![* Громова О.И * Схема гидролиза NH4Cl NH4Cl NH4OH HCl слабое основание сильная кислота Сила побеждает! [OH–] < [H+] Кислая среда Громова О.И * Громова О.И * Схема гидролиза NH4Cl NH4Cl NH4OH HCl слабое основание сильная кислота Сила побеждает! [OH–] < [H+] Кислая среда Громова О.И](https://fs3.ppt4web.ru/images/132073/183857/640/img11.jpg)

![* Громова О.И * Схема гидролиза AlCl3 AlCl3 Al(OH)3 HCl слабое основание сильная кислота Сила побеждает! [OH–] < [H+] Кислая среда Громова О.И * Громова О.И * Схема гидролиза AlCl3 AlCl3 Al(OH)3 HCl слабое основание сильная кислота Сила побеждает! [OH–] < [H+] Кислая среда Громова О.И](https://fs3.ppt4web.ru/images/132073/183857/640/img13.jpg)

![* Громова О.И * Схема гидролиза Al2S3 Al2S3 Al(OH)3 H2S слабое основание слабая кислота Сила побеждает! [OH–] ? [H+] Среду можно определить по Кg Громова О.И * Громова О.И * Схема гидролиза Al2S3 Al2S3 Al(OH)3 H2S слабое основание слабая кислота Сила побеждает! [OH–] ? [H+] Среду можно определить по Кg Громова О.И](https://fs3.ppt4web.ru/images/132073/183857/640/img15.jpg)

![* Громова О.И * Схема гидролиза NaCl NaCl NaOH HCl сильное основание сильная кислота Сила побеждает! [OH–] = [H+] Нейтральная среда Громова О.И * Громова О.И * Схема гидролиза NaCl NaCl NaOH HCl сильное основание сильная кислота Сила побеждает! [OH–] = [H+] Нейтральная среда Громова О.И](https://fs3.ppt4web.ru/images/132073/183857/640/img17.jpg)