Презентация на тему: Основания

Тема урока: "Основания"Выполнено Романовой В.П.учителем химии первой категории МОУ «Ардинская СОШ»

Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними ионов гидроксильных групп.

Валентность гидроксогруппы – Количество гидроксогрупп определяется валентностью металла, образующего основание. Например:

Название основанийГидроксид Название металла в родительном падежеВалентность римскими цифрами

Дайте названия гидроксидам
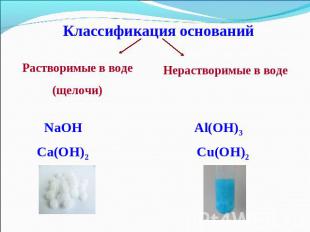
Классификация основанийРастворимые в воде(щелочи)Нерастворимые в воде

Получение оснований и их свойства

Взаимодействие натрия с водой

Взаимодействие основных оксидов с водой

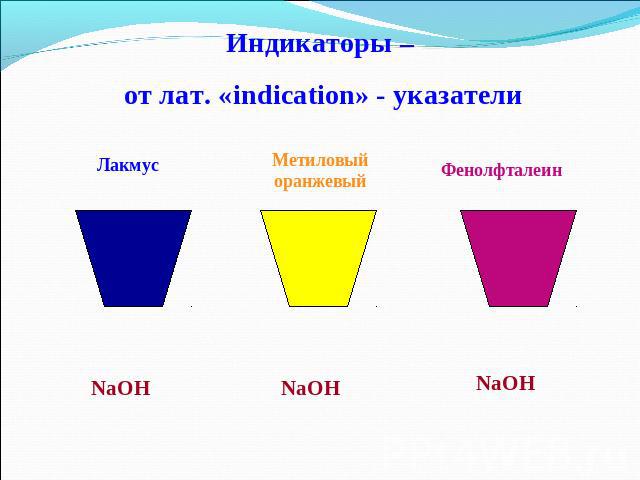
Действие щелочей на индикаторы
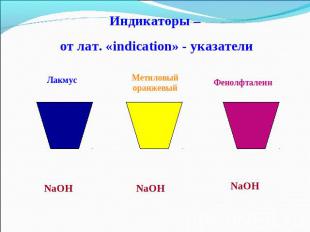
Индикаторы – от лат. «indication» - указатели
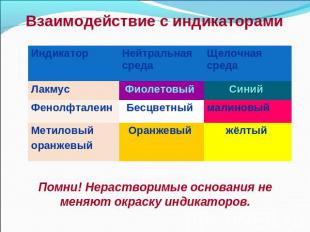
Взаимодействие с индикаторами Помни! Нерастворимые основания не меняют окраску индикаторов.

Щёлочь + оксид неметалла → соль + вода ( реакция обмена) УСЛОВИЕ: оксиду неметалла должна соответствовать определенная кислота например: N2+5O5 → H N+5O3 S+6O3 → H2 S+6O4

Щелочь + соль → новое основание + новая соль ( реакция обмена) УСЛОВИЯ: образуется осадок; выделяется газ.6KOH+Fe2(SO4)3→2Fe(OH)3↓+ 3K2SO4

Получение нерастворимых оснований

Химические свойства нерастворимых оснований

Нерастворимое основание →оксид металла + вода (разложение при нагревании)Mg(OH)2 ↓→ MgO + H2O2Fe(OH)3 ↓→ Fe2O3 + 3H2OДанный тип реакции нехарактерен для растворимых оснований
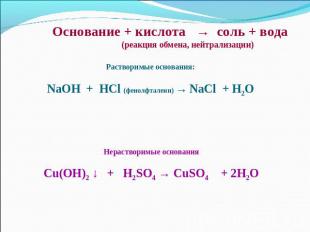
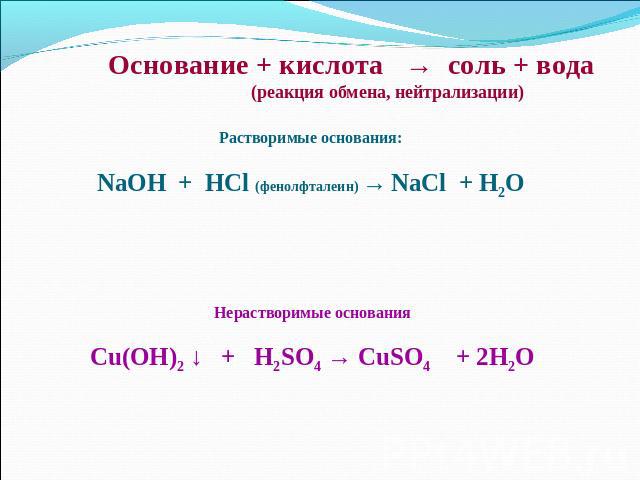
Основание + кислота → соль + вода (реакция обмена, нейтрализации)Растворимые основания:NaOH + HCl (фенолфталеин) → NaCl + H2OНерастворимые основанияCu(OH)2 ↓ + H2SO4 → CuSO4 + 2H2O