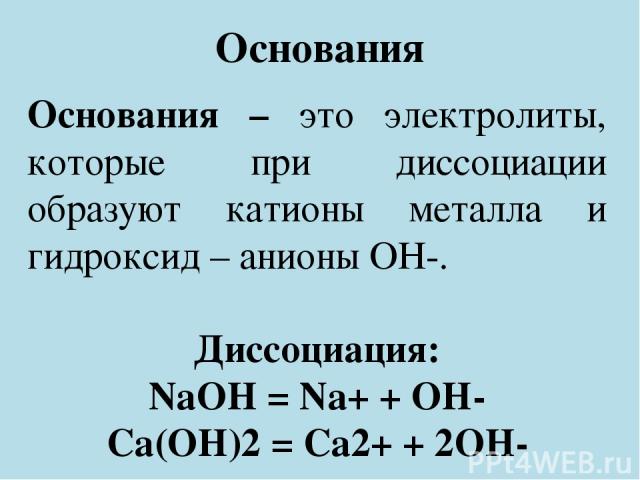
Презентация на тему: Основания

Типичные реакции оснований 1) Основание + кислота = соль + вода Например: NaOH + HNO3 = NaNO3 + H2O

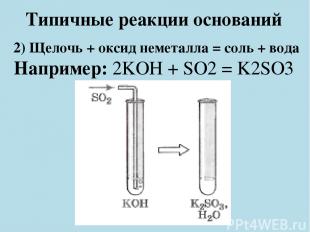
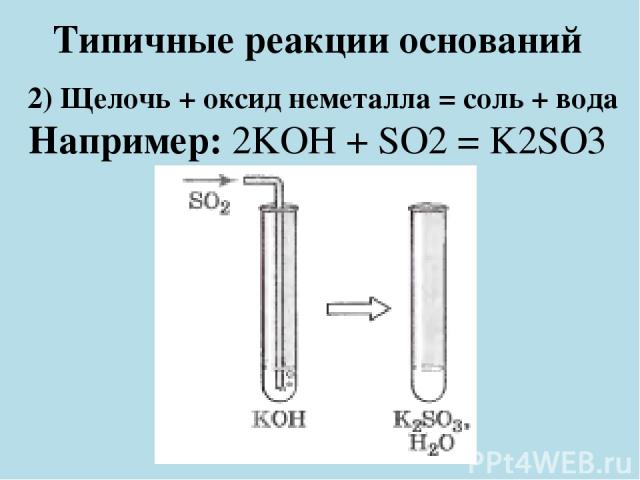
Типичные реакции оснований 2) Щелочь + оксид неметалла = соль + вода Например: 2KOH + SO2 = K2SO3 + H2O

Классификация оснований По растворимости Растворимые Нерастворимые гидроксид кальция гидроксид меди (II)
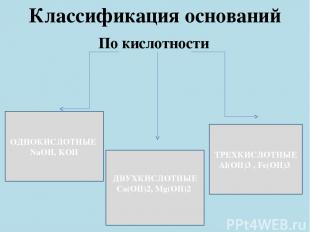
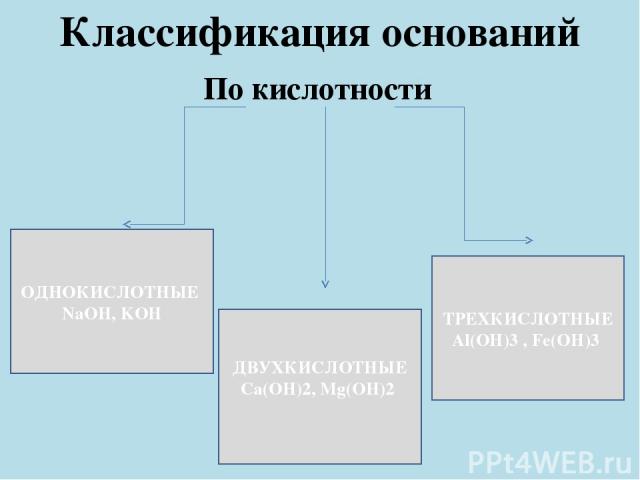
Классификация оснований По кислотности ОДНОКИСЛОТНЫЕ NaOH, KOH ДВУХКИСЛОТНЫЕ Ca(OH)2, Mg(OH)2 ТРЕХКИСЛОТНЫЕ Al(OH)3 , Fe(OH)3
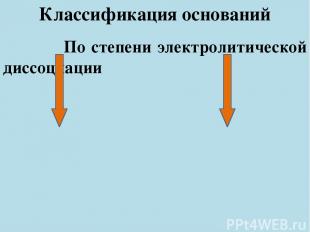
Классификация оснований По степени электролитической диссоциации Сильные Слабые Например: Например: Щелочи Нерастворимые (KOH, NaOH) основания (Cu(OH)2, Al(OH)3)

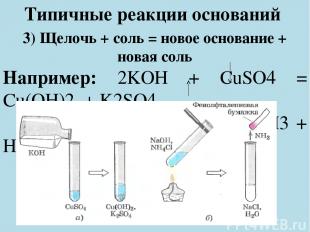
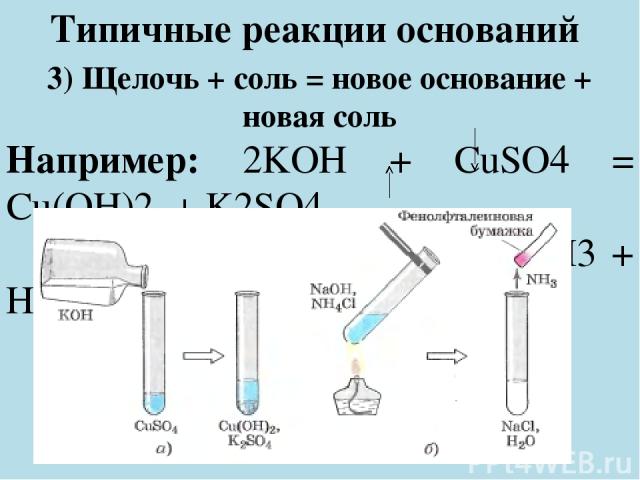
Типичные реакции оснований 3) Щелочь + соль = новое основание + новая соль Например: 2KOH + CuSO4 = Cu(OH)2 + K2SO4 NaOH + NH4Cl = NaCl + NH3 + H2O

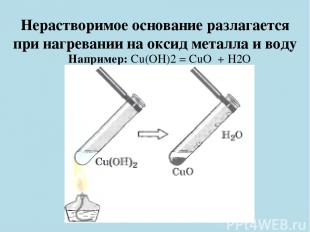
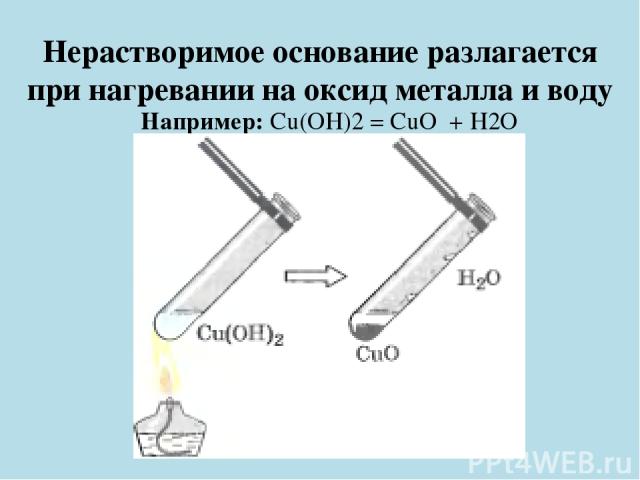
Нерастворимое основание разлагается при нагревании на оксид металла и воду Например: Cu(OH)2 = CuO + H2O
Практическое применение оснований В строительстве; в мыловарении; в качестве дезинфицирующих средств; в кожевенной промышленности; в фармацевтической промышленности и т.д.;
Обобщение темы: Тест: «Выбери ответ» 1) Гидроксид кальция – это основание: а) однокислотное б) двухкислотное в) трехкислотное г) это не основание 2) Взаимодействие основания и кислоты является реакцией: а) разложения б) замещения в) соединения г) обмена 3) При нагревании на оксид металла и воду разлагается: а) NaOH б) KOH в) Cu(OH)2 г) LiOH
Домашнее задание: § 39 Упр. 2, 3, 4.

Список источников 1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил. Использованы фотографии: https://ru.wikipedia.org/wiki/%C3%E8%E4%F0%EE%EA%F1%E8%E4_%EA%E0%EB%FC%F6%E8%FF#mediaviewer/File:Calcium_hydroxide.jpg гидроксид кальция https://ru.wikipedia.org/wiki/%C3%E8%E4%F0%EE%EA%F1%E8%E4_%EC%E5%E4%E8(II)#mediaviewer/File:Copper_(II)_hydroxide.JPG гидроксид меди (II)










![Список источников 1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил. Использованы фотографии: https://ru.wikipedia.org/wiki/%C3%E8%E4%F0%EE%EA%F1%E8%E4_%EA… Список источников 1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил. Использованы фотографии: https://ru.wikipedia.org/wiki/%C3%E8%E4%F0%EE%EA%F1%E8%E4_%EA…](https://fs3.ppt4web.ru/images/132018/172064/640/img10.jpg)
















