Презентация на тему: Коррозия железа в различных средах

Коррозия железа в различных средах Проект по химии: Авторы: ученица 10б класса МБОУ СОШ №20 Ковалёва Елена Руководитель Дунаева И.И.- учитель химии МБОУ СОШ № 20 города Невинномысска

Цель проекта изучить процесс коррозии металлов в различных средах на примере железа.

Изучить литературу и другие источники информации по теме исследования2. Определить экспериментальным путём влияние различных агрессивных сред на коррозию железа3. Создать презентацию по данной теме для демонстрации на уроках и внеклассных занятий.

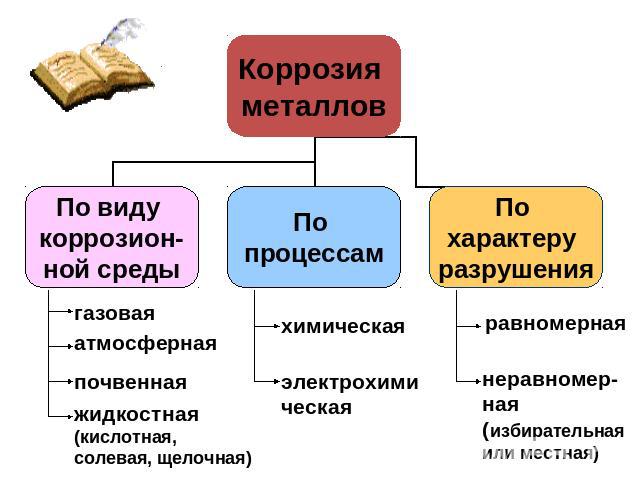
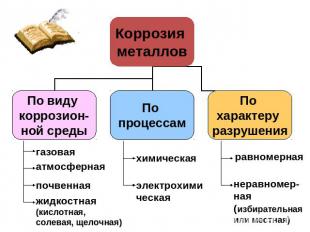
Введение1. Литературный обзор. 1.1. Понятие коррозии1.2. Классификация коррозионных процессов.1.2.1. По типу разрушений. 1.2.2. По механизму разрушений. 2. Методы защиты от коррозии. 3. Экспериментальная частьЗаключение

Понятие коррозии. Коррозия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример — кислородная коррозия железа в водной среде: 4Fe + 6Н2О + ЗО2 = 4Fe(OH)3. Гидратированный оксид железа Fe(OН)3 и является тем, что называют ржавчиной.

Коррозия металла. Ржавчина, самый распространенный вид коррозии.

Учёные, занимавшиеся изучением процессов коррозии. Якоби Б.С.-открытие гальванопластики.Бекетов Н.Н.-основоположник физической химии , академик Петербугской АН (1886)Даниель Дж. Фредерик -физик, химик, профессор Королевского колледжа (1831)

Практическая часть Для исследования было взято 7 железных пластинок примерно одинакового размера и формы.

Все пластинки были помещены в стаканы с различной средой:1.Вода 2.Слабый раствор KOH 3. Слабый раствор кислоты4. Раствор фосфорной кислоты5. Раствор поваренной соли6. Слабый раствор соляной кислоты

Результаты 1. Водный раствор

Результаты 2.Слабый щелочной раствор

Результаты3. Раствор фосфорной кислоты

Результаты4. Раствор фосфорной кислоты более концентрированый

Результаты5.Раствор поваренной соли

Результаты6.Слабокислый раствор соляной кислоты

Результаты исследования показали, что самой агрессивной средой для железа стала вода, раствор соляной кислоты и раствор поваренной соли. Раствор шелочи практически не повлиял на процесс коррозии, т.к щелочная среда является ингибитором, раствор фосфорной кислоты разрушил пластинку в связи с химической реакцией (образуется фосфат железа (2) – зеленый раствор и выделяется водород.

Необходимость осуществления мероприятий по защите от коррозии диктуется тем обстоятельством, что потери от коррозии приносят чрезвычайно большой ущерб. Защита от коррозии является одной из важнейших проблем, имеющей большое значение для народного хозяйства. Коррозия является физико-химическим процессом, защита же от коррозии металлов – проблема химии в чистом виде.

Нанесение защитных покрытий (лаки, краски, эмали);Покрытие другим металлом (позолота, серебрение, хромирование, цинкование);Создание и использование антикоррозионных сплавовВведение в среду ингибиторов, снижающих агрессивность среды;Протекторная защита

Классификация коррозионных процессов. По типу разрушений. По типу разрушений коррозия бывает сплошной и местной.При равномерном распределении коррозионных разрушений по всей поверхности металла коррозию называют равномерной или сплошной.

Химическая коррозия: Химическая коррозия: Химическая коррозия — взаимодействие поверхности металла с (коррозионно-активной) средой, В этом случае взаимодействия окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Например, образование окалины при взаимодействии материалов на основе железа при высокой температуре с кислородом: 4Fe + 3O2 → 2Fe2O3Окисление - восстановление
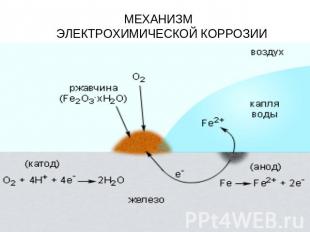
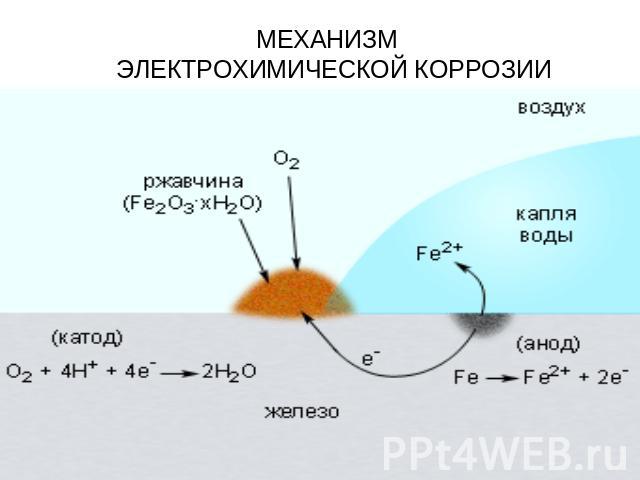
МЕХАНИЗМ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ

Электрохимическая коррозия: Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. В этой реакции всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды - либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот, или т.п., электропроводность ее повышается, и скорость процесса увеличивается.

Особенно разнообразные процессы химической коррозии встречаются в различных химических производствах. В атмосфере водорода, метана и других углеводородов, оксида углерода (II), сероводорода, хлора, в среде кислот, щелочей, солей, а также в расплавах солей и других веществ протекают специфические реакции с вовлечением материала аппаратов и агрегатов, в которых осуществляется химический процесс. Задача специалистов при конструировании реактора – подобрать металл или сплав, который был бы наиболее устойчив к компонентам химического процесса.Строго отделить химическую коррозию от электрохимической трудно, а иногда и невозможно. Дело в том, что электрохимическая коррозия часто связана с наличием в металле случайных примесей или специально введенных легирующих добавок.Многие неопытные химики в разное время были озадачены тем, что иногда реакцияZn + H2SO4 = ZnSO4 + H2описанная во всех учебниках, не идет. Более опытные химики знают, что в такой ситуации в раствор нужно добавить немного сульфата меди (П) (медного купороса). В этом случае на поверхности цинка выделится медьCuSO4 + Zn = ZnSO4 + Cu

Водородная и кислородная коррозия Если происходит восстановление ионов H3O+ или молекул воды H2O, говорят о водородной коррозии или коррозии с водородной деполяризацией. Восстановление ионов происходит по следующей схеме:2H3O+ + 2e− → 2H2O + H2или2H2O + 2e− → 2OH− + H2Если водород не выделяется, что часто происходит в нейтральной или сильно щелочной среде, происходит восстановление кислорода и здесь говорят о кислородной коррозии или коррозии с кислородной деполяризацией:O2 + 2H2O + 4e− → 4OH−Коррозионный элемент может образовываться не только при соприкосновении двух различных металлов. Коррозионный элемент образуется и в случае одного металла, если, например, структура поверхности неоднородна.

Техника борьбы с коррозией. Том 1. Перевод с польского. Под ред. А.М. Сухотина – Л.: Химия, 1978.Техника борьбы с коррозией. Том 2. Перевод с польского к.х.н. В.И. Грибеля. – Л.: Химия, 1980.Коррозия и защита химической аппаратуры. Том 1. Под ред. А.М. Сухотина. – Л.: Химия, 1969.Розенфельд И.Л., Рубинштейн Ф.И., Жигалова К.А. Защита металлов от коррозии лакокрасочными покрытиями. – М.: Химия, 1987.Способы защиты оборудования от коррозии. Под ред. Б.В. Строкана, А.М. Сухотина. – Л.: Химия, 1987.Клинов И.Я., Удыма П.Г., Молоканов А.В., Горяинова А.В. Химическое оборудование в коррозионностойком исполнении. – М.: Машиностроение, 1970.Клинов И.Я. Коррозия химической аппаратуры и коррозионностойкие материалы. – М.: Машгиз, 1960.Коррозия. Под ред. Л.Л. Шрайера. – М.: Металлургия, 1981.Коррозия оборудования в производстве галогенсодержащих веществ. Под ред. Д.т.н. проф. В.С. Зотикова. – СПб.: Теза, 1998.Тищенко Г.П., Тищенко И.Г., Вихрова З.Г. Применение нетоксичных и малотоксичных ингибиторов коррозии в промышленности. – М.: НИИТЭХИМ, 1990.