Презентация на тему: Изучение коррозии и защиты металлов

ХимияИзучение коррозии и защиты металлов

ЦельИзучение проблемы коррозии металлов и исследование коррозийной стойкости металлов и способов их защиты

Задачи изучить литературу по теме исследований;исследовать коррозийную устойчивость оксидных пленок:сделать вывод о защитных свойствах различных участков оксидной пленки, образующейся на металле:сравнить скорость появления медных пятен на поверхности стальной пластинки;сделать фотографии медных пятен;рассмотреть процессы коррозии оцинкованного железа и луженой жести и сравнить их;определить радиус действия цинкового протектора при защите стали в растворах хлорида натрия различной концентрации;составить график, выражающий зависимость радиуса действия протектора от концентрации растворов хлорида натрия.

Новизна исследования Исследование коррозийной стойкости металлов и объяснение её с точки зрения электродных потенциалов

Коррозия Самопроизвольное разрушение металлов и металлических материалов (сплавов) под воздействием окружающей среды называется коррозиейСуществуют разные виды коррозии металлов и их сплавов. Наиболее распространены два вида:а) Химическая коррозияб) Электрохимическая коррозия

Электродный потенциал Электродный потенциал является важной количественной характеристикой восстановительных свойств металла и окислительных свойств его иона. Он характеризует также способность металла переходить в гидратированный ион. Двойной электрический слой . Схема гальванического элемента.
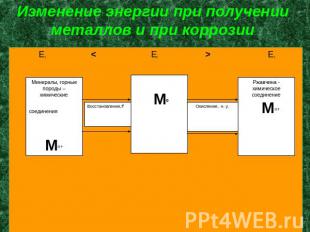
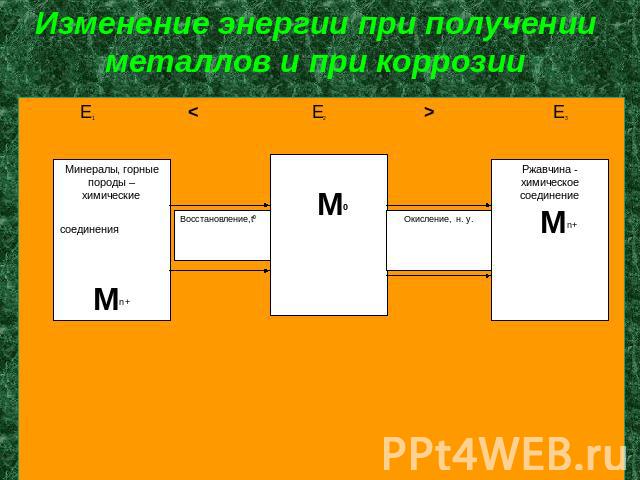
Изменение энергии при получении металлов и при коррозии

Стандартные электродные потенциалы металлов и их ионов в водных растворах

Химическая коррозия Химическая коррозия- это вид коррозии, обусловленный непосредственным взаимодействием металла или сплава с сухими газами, жидкостями, не являющимися электролитами, твёрдыми веществами. Суть её заключена в окислении металла в процессе непосредственного химического взаимодействия с веществами окружающей среды (газовая, жидкостная коррозия).Примером газовой коррозии может служить окисление железа в атмосфере хлора:
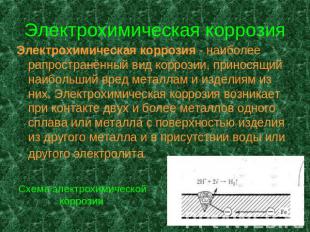
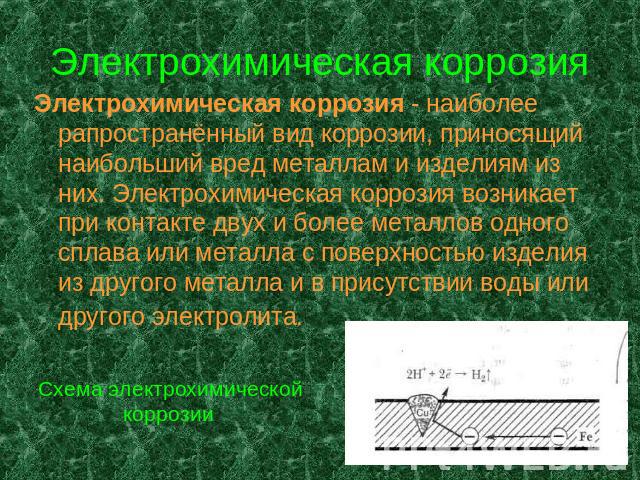
Электрохимическая коррозия Электрохимическая коррозия - наиболее рапространённый вид коррозии, приносящий наибольший вред металлам и изделиям из них. Электрохимическая коррозия возникает при контакте двух и более металлов одного сплава или металла с поверхностью изделия из другого металла и в присутствии воды или другого электролита. Схема электрохимической коррозии

Методы борьбы с коррозией

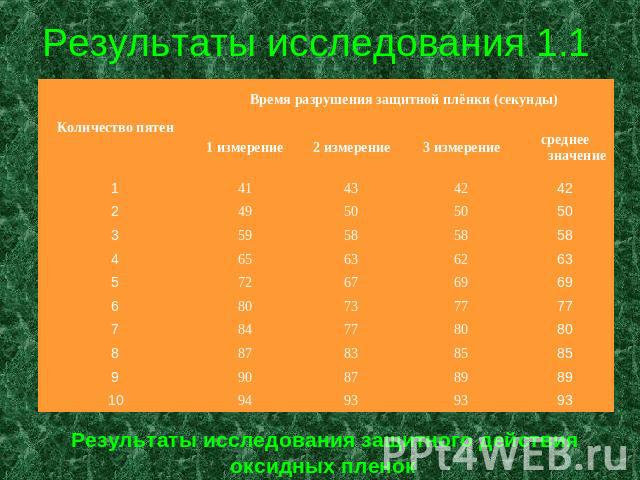
Опыт №1 Испытание коррозийной устойчивости оксидных плёнокОбъект исследования: стальная пластинка длиной 25 см, шириной 2 см, очищенная наждачной бумагой.Методика проведения исследования. Один конец пластинки зажимают держателем лабораторного штатива, а другой помещают над пламенем спиртовки. На пластинке (по мере ее нагревания) появляются цвета побежалости. Пластинку снимают с огня и охлаждают. На охлажденную пластинку через каждые 2 см по длине пластинки наносят по капле 0, 1 М раствора кристаллогидрата сульфата меди (CuSO4 * 5 H2O). По скорости появления медного пятна судят о защитных свойствах различных участков оксидной пленки, образующейся на металле. Скорость появления пятна определяют секундомером. [2]

Цвета побежалости

Таблица определения температуры нагрева по цветам побежалости

Медные пятна на стальной пластинке

Результаты исследования 1.1 Результаты исследования защитного действия оксидных пленок
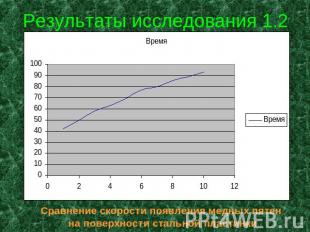
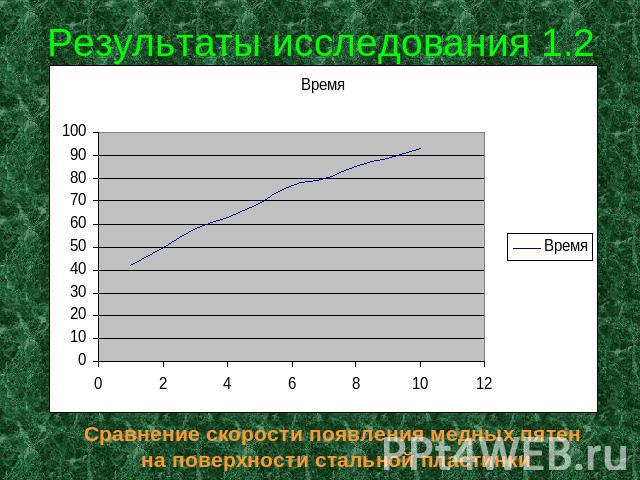
Результаты исследования 1.2 Сравнение скорости появления медных пятен на поверхности стальной пластинки

Опыт №2 Коррозия оцинкованного железа и луженой жестиОбъекты исследования: пластинки стальные, цинковые и оловянные.Методика проведения эксперимента.В стакан емкостью 200 мл наливают дистиллированную воду, к ней добавляют 20 капель концентрированного раствора серной кислоты и 5-6 капель раствора красной кровяной соли K3 [Fe(CN)6] Раствор размешивают и разливают поровну в два других стакана емкостью 100 мл. В один из них погружают стальную пластинку с присоединенной к ней пластинкой (кусочком) цинка. В другой стакан погружают такую же пластинку, соединенную с пластинкой олова. Через некоторое время сравнивают окраску растворов в стаканчике №1 и №2. [2]

Коррозия оцинкованного железа и лужёной жести

Результаты исследования 2.1 Стакан №1а) система Zn – Fe: А (-) Zn e- → Zn2+ в растворе ↓ К(+)Fe → 2 e- + 2H+ (из раствора) = Н2 Е0 (Zn2+ |Zn) = - 0,76 В; Е0 (Fe2+ | Fe) = - 0,44 В.Е = Е0 (Fe2+ | Fe) - E0(Zn2+ | Zn); Е = [-0, 44 – (-0,76)] = 0, 32 В.

Результаты исследования 2.2 Стакан №2б) система Fe – Sn: К(+)Sn → 2 e- + 2H+ (из раствора) = Н2 А(-)Fe e- → Fe2+ в раствореЕ0 (Sn2+|Sn) = - 0,14 В; Е0 (Fe2+ | Fe) = - 0,44В.Е = E0 (Sn2+ | Sn) - Е0 (Fe2+| Fe) ; Е = [-0, 14 – (-0,44)] = 0, 30 В.2K3[Fe(CN)6] + 3FeSO4 → Fe3[Fe(CN)6]2 ↓ + 3K2SO4

Опыт №3 Электрохимическая защита металлов от коррозии (протекторная защита)Объект исследования: стальной стрежень (зачищенный наждачной бумагой, промытый в воде и обёрнутый фильтровальной бумагой) длиной 25 см и диаметром 8 мм на одном конце, которого прикреплён кусок цинка длиной 1см.Методика проведения эксперимента:Приготавливают по 2 л 0,1%(№1), 0,2%(№2), 0,3%(№3) , 1,5%(№4) растворов хлорида натрия; 10% раствор красной кровяной соли.К 2 л каждого из приготовленных растворов хлорида натрия приливают по 1 мл 10% раствора красной кровяной соли и перемешивают. В ванну для раствора ставят стальной стержень на стальных подставках (рис.). Раствор №1 вливают через воронку, доходящую до дна ванны. Через 10-15 минут при помощи миллиметровой линейки определяют расстояние от места прикрепления протектора до первого синего пятна на стальном стержне.Выливают раствор №1, вынимают образец, тщательно промывают его под струей водопроводной воды и протирают фильтровальной бумагой. Ванну и подставки ополаскивают водопроводной водой. Радиус действия протектора в растворе №1 и других растворах определяют так же, как в растворе №1. Такой же опыт проводят с водопроводной водой. [2]

Стаканы с растворами хлорида натрия

Установка для определения радиуса действия протектора

Появление синего пятна Образование турнбулевой сини вследствие взаимодействия красной кровяной соли с железом в степени окисления +2
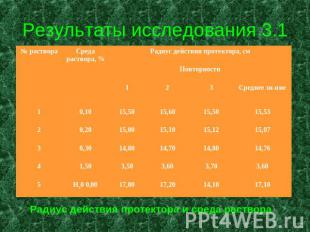
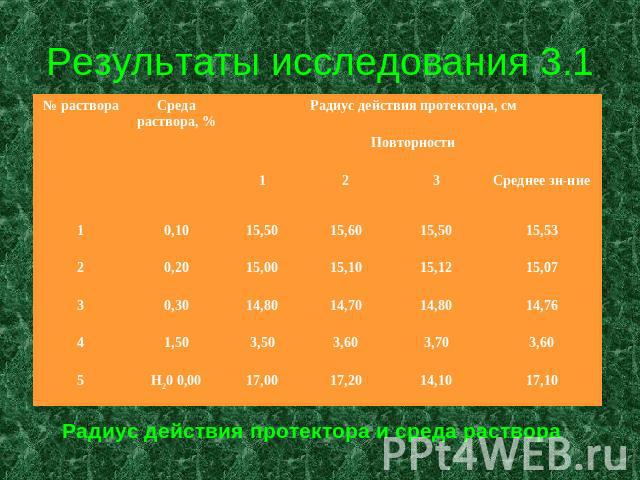
Результаты исследования 3.1 Радиус действия протектора и среда раствора
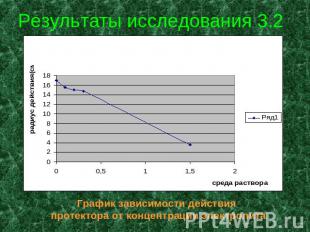
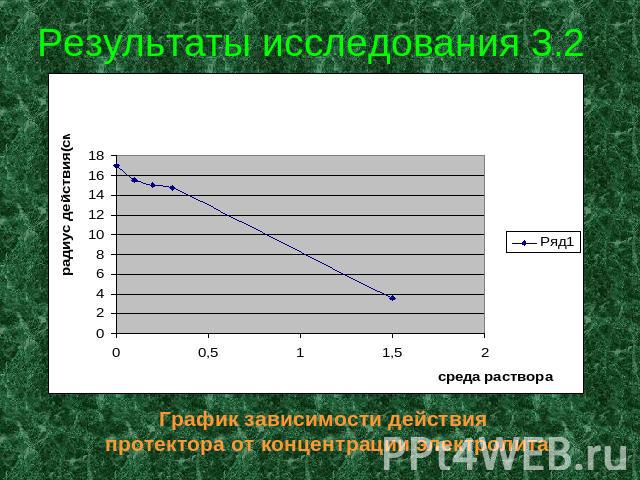
Результаты исследования 3.2 График зависимости действия протектора от концентрации электролита

Заключение 1. Проведено исследование коррозийной устойчивости оксидных плёнок (результаты оформлены в таблице и был начерчен график зависимости скорости появления медного пятна на стальной пластинке с течением времени)

Заключение 2. Исходя из опыта (испытание коррозийной устойчивости оксидных плёнок) можно сделать вывод, чем тоньше оксидная пленка на поверхности металла, тем более металл подвержен коррозии.

Заключение 3. По результатам проведения опыта (оксидирование стальных изделий) нами было выяснено, оксидированные металлические пластинки менее подвержены коррозии, нежели не оксидированные.

Заключение 4. Нами было проведено сравнение оцинкованного железа и луженой жести, в ходе которого выяснено, что при коррозии оцинкованного железа вначале растворяется не железо, а цинк этот способ защиты металла от коррозии называется протекторным, т.е., железо можно предохранить от коррозии путем соединения его с более активным металлом

Заключение 5. В опыте действие цинкового протектора при защите стали в растворах хлорида натрия различной концентрации, мы выяснили, что радиус действия протектора зависит от среды электролита. Расстояние, на которое распространяется защитное действие протектора, тем больше, чем выше электрическая проводимость среды, в которой находится защищаемый металл, и чем больше разность потенциалов протектора и металла. В нашем опыте разность потенциалов: Е0 (Zn2+ |Zn) = - 0,76 В; Е0 (Fe2+ | Fe) = - 0,44 В.Е = Е0 (Fe2+ | Fe) - E0 (Zn2+ | Zn) ; Е = [-0, 44 – (-0,76)] = 0, 32 В.

Исследование проводили: Махонин Владислав НиколаевичСулимов Павел АндреевичНаучный руководитель:Шахова Татьяна Николаевна

До следующего исследования
















![Результаты исследования 2.1 Стакан №1а) система Zn – Fe: А (-) Zn e- → Zn2+ в растворе ↓ К(+)Fe → 2 e- + 2H+ (из раствора) = Н2 Е0 (Zn2+ |Zn) = - 0,76 В; Е0 (Fe2+ | Fe) = - 0,44 В.Е = Е0 (Fe2+ | Fe) - E0(Zn2+ | Zn); Е = [-0, 44 – (-0,76)] = 0, 32 В. Результаты исследования 2.1 Стакан №1а) система Zn – Fe: А (-) Zn e- → Zn2+ в растворе ↓ К(+)Fe → 2 e- + 2H+ (из раствора) = Н2 Е0 (Zn2+ |Zn) = - 0,76 В; Е0 (Fe2+ | Fe) = - 0,44 В.Е = Е0 (Fe2+ | Fe) - E0(Zn2+ | Zn); Е = [-0, 44 – (-0,76)] = 0, 32 В.](/images/1194/31458/640/img19.jpg)
![Результаты исследования 2.2 Стакан №2б) система Fe – Sn: К(+)Sn → 2 e- + 2H+ (из раствора) = Н2 А(-)Fe e- → Fe2+ в раствореЕ0 (Sn2+|Sn) = - 0,14 В; Е0 (Fe2+ | Fe) = - 0,44В.Е = E0 (Sn2+ | Sn) - Е0 (Fe2+| Fe) ; Е = [-0, 14 – (-0,44)] = 0, 30 В.2K3[Fe… Результаты исследования 2.2 Стакан №2б) система Fe – Sn: К(+)Sn → 2 e- + 2H+ (из раствора) = Н2 А(-)Fe e- → Fe2+ в раствореЕ0 (Sn2+|Sn) = - 0,14 В; Е0 (Fe2+ | Fe) = - 0,44В.Е = E0 (Sn2+ | Sn) - Е0 (Fe2+| Fe) ; Е = [-0, 14 – (-0,44)] = 0, 30 В.2K3[Fe…](/images/1194/31458/640/img20.jpg)