Презентация на тему: Кислоты

Типичные реакции кислот 1) Кислота + основание = соль + вода Например: HNO3+ NaOH = NaNO3 + H2O

Кислоты Кислоты – это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация: HCl = H+ + Cl- НNO3 = H+ + NO3-

Классификация кислот По растворимости Растворимые Нерастворимые азотная кислота осадок кремниевой кислоты

Классификация кислот По наличию кислорода Кислородсодержащие Бескислородные уксусная кислота соляная кислота
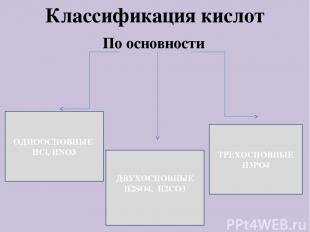
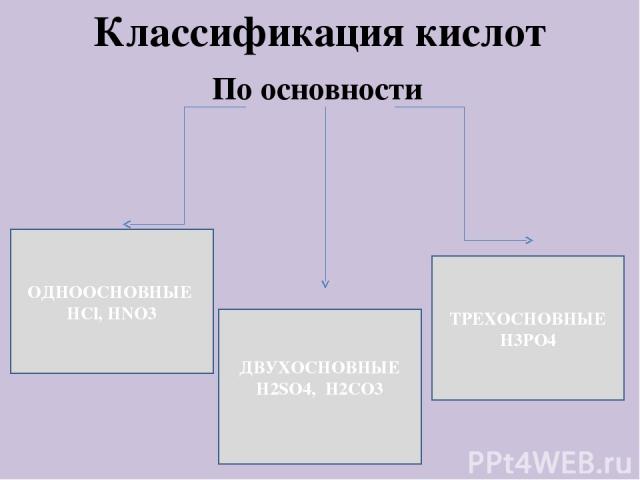
Классификация кислот По основности ОДНООСНОВНЫЕ НСl, HNO3 ДВУХОСНОВНЫЕ H2SO4, H2CO3 ТРЕХОСНОВНЫЕ H3PO4
Классификация кислот По летучести Летучие Нелетучие Например: Например: H2S (сероводородная) H3PO4 (фосфорная) HCl (соляная) H2SO4 (серная) HNO3 (азотная)

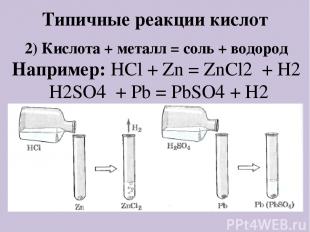
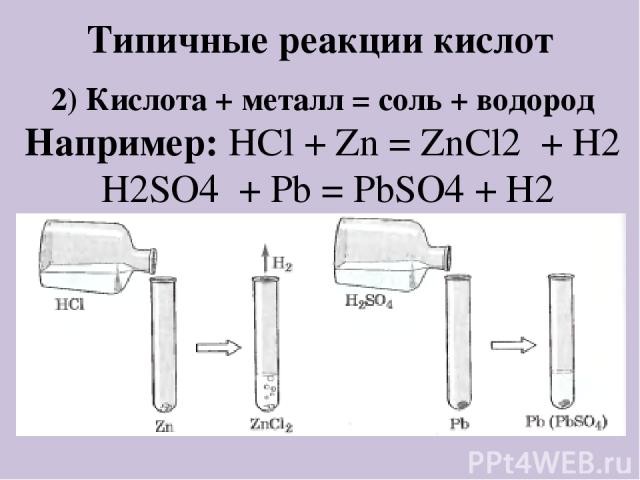
Типичные реакции кислот 2) Кислота + оксид металла = соль + вода Например: H2SO4+ CuO = CuSO4 + H2O

Практическое применение кислот Производство лекарств; химических продуктов и товаров; минеральных удобрений; красок; пластмасс и т.д.;

Обобщение темы: Тест: «Проверь себя» 1) Серная кислота – это кислота: а) одноосновная б) трехосновная в) двухосновная г) это не кислота 2) Кислоты – это электролиты, состоящие из катионов: а) металла б) кислорода в) серы г) водорода 3) Реакцией замещения будет взаимодействие кислоты с: а) металлом б) солью в) основанием г) оксидом
Домашнее задание: § 38 Упр. 1, 4.

Список источников 1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил. Использованы фотографии: http://doctoraibolit.com/ru/homeopathy/2--acidum-nitricum.html азотная кислота http://mashintop.ru/articles.php?id=1299 осадок кремниевой кислоты http://www.ati.com.ua/foto-uksusnaya-kislota-ledyanaya_bbf_517977.html уксусная кислота http://m.topnews.ru/event/50876 соляная кислота














![Список источников 1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил. Использованы фотографии: http://doctoraibolit.com/ru/homeopathy/2--acidum-nitricum.htm… Список источников 1) Габриелян О.С. Химия. 8 класс: учеб. для общеобразоват. учрежд. / О.С. Габриелян. – 16 изд., стереотип. – М.: Дрофа, 2010.-270 с., [2]с.: ил. Использованы фотографии: http://doctoraibolit.com/ru/homeopathy/2--acidum-nitricum.htm…](https://fs3.ppt4web.ru/images/132018/172069/640/img10.jpg)

















