Презентация на тему: Протекание химических реакций между растворами электролитов до конца

Феоктистова Татьяна Ивановна Учитель химии ГБОУ ЦО № 2051 г. Москвы «Протекание химических реакций между растворами электролитов до конца» Команда «Электрон» ГБОУ СОШ № 2031 города Москвы представляет Творческое задание 1 тура «Изучение условий протекания химических реакций между растворами электролитов до конца» на конкурс «Путешествие в мир химии 2013-2014», проводимый Ярославским Центром телекоммуникаций и информационных систем в образовании.

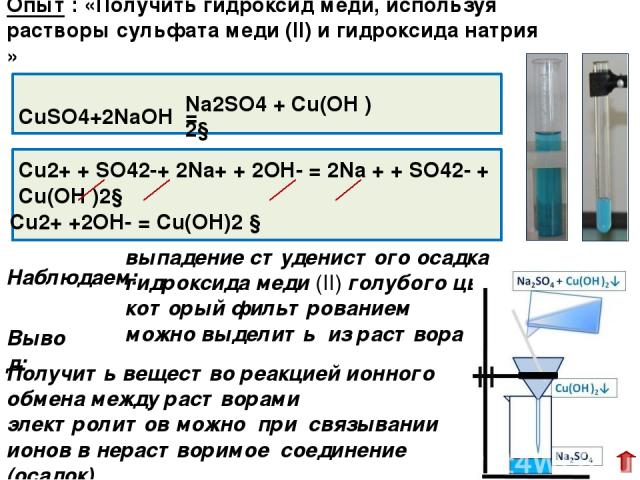
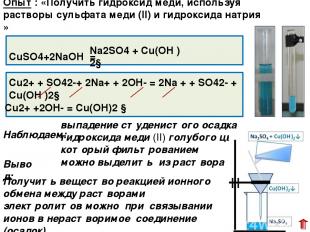
СuSO4+2NaOH = выпадение студенистого осадка гидроксида меди (II) голубого цвета, который фильтрованием можно выделить из раствора Cu2+ + SO42-+ 2Na+ + 2OH- = 2Na + + SO42- + Cu(OH )2↓ Наблюдаем: Опыт : «Получить гидроксид меди, используя растворы сульфата меди (II) и гидроксида натрия » Na2SO4 + Cu(OH )2↓ Получить вещество реакцией ионного обмена между растворами электролитов можно при связывании ионов в нерастворимое соединение (осадок) Cu2+ +2OH- = Cu(OH)2 ↓ Вывод: Задание первое опыта № 1 было изучение взаимодействия сульфата меди (II) с гидроксидом натрия. Проведя опыт, мы убедились, что реакция протекает до конца, и фильтрованием мы выделили из раствора образовавшийся голубой осадок гидроксида меди (II)
3KCl + Na3PO4 → Изменений не наблюдается, реакция не протекает, соли невозможно выделить из раствора. 3K+ + 3Cl-+ 3Na+ + PO43- → 3K+ + PO43- + 3Na+ +3Cl- Наблюдаем: K3PO4 + 3NaCl Опыт : «Получить соли взаимодействием хлорида калия с фосфатом натрия и выделить их из раствора» ↔ Между ионами в растворе установилось химическое равновесие, следовательно реакция не протекает до конца! Для того, чтобы реакция между электролитами протекла необратимо, необходимо, чтобы часть ионов оказалась связанной или в летучее соединение (газ), или в осадок, или в слабый электролит. Задание второе опыта № 1 было изучение взаимодействия хлорида калия с фосфатом натрия. Результатом опыта не наблюдалось никаких изменений, а вещества из раствора невозможно было выделить. Следовательно реакция не протекает до конца, а между ионами в растворе устанавливается химическое равновесие.

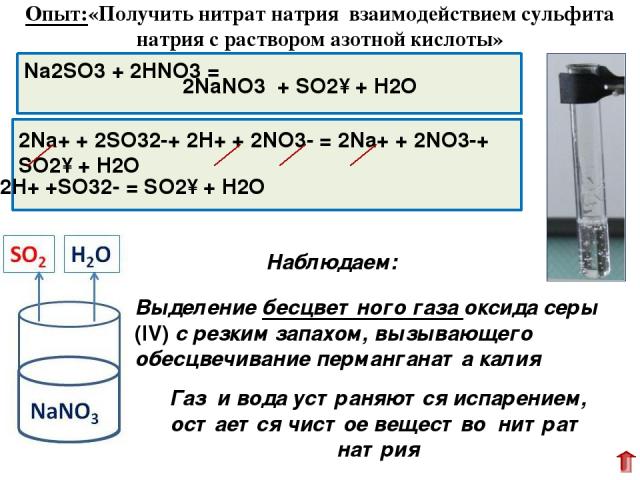
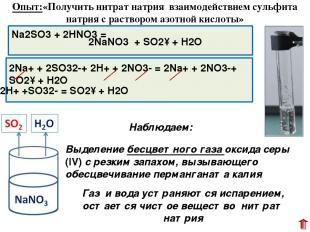
Na2SO3 + 2HNO3 = Выделение бесцветного газа оксида серы (IV) с резким запахом, вызывающего обесцвечивание перманганата калия 2NaNO3 + SO2↑ + H2O 2Na+ + 2SO32-+ 2H+ + 2NO3- = 2Na+ + 2NO3-+ SO2↑ + H2O Опыт:«Получить нитрат натрия взаимодействием сульфита натрия с раствором азотной кислоты» Наблюдаем: Газ и вода устраняются испарением, остается чистое вещество нитрат натрия 2H+ +SO32- = SO2↑ + H2O Далее мы приступили к выполнению заданий второго опыта. Первое задание провести взаимодействия сульфита натрия с раствором азотной кислоты показало выделение газа. Поэтому одно вещество было отделено от другого.
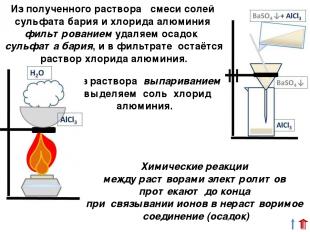
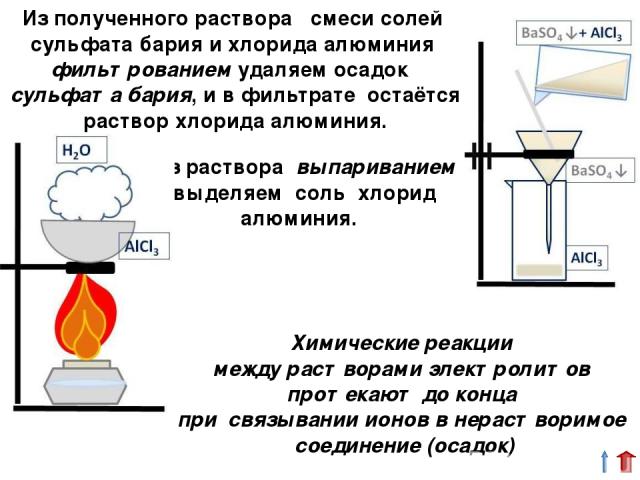
Из полученного раствора смеси солей сульфата бария и хлорида алюминия фильтрованием удаляем осадок сульфата бария, и в фильтрате остаётся раствор хлорида алюминия. Из раствора выпариванием выделяем соль хлорид алюминия. Химические реакции между растворами электролитов протекают до конца при связывании ионов в нерастворимое соединение (осадок)

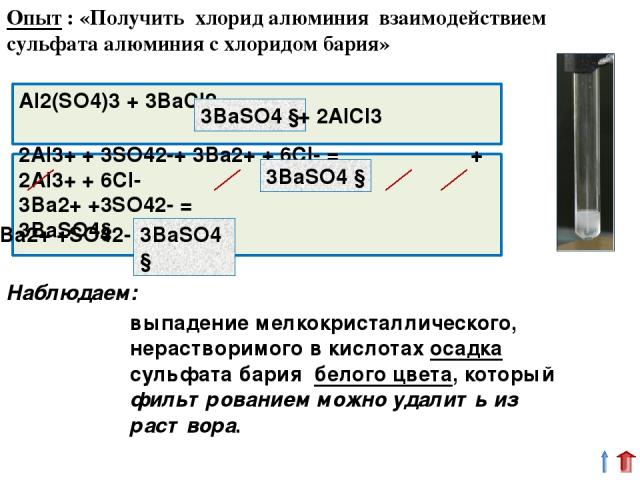
Доказываем: чтобы реакция между растворами электролитов протекала до конца, необходимо, чтобы часть ионов оказалась связанной в осадок Ba2+ +SO42- = BaSO4 ↓ Опытом № 1 Мы доказываем: чтобы реакция между растворами электролитов протекала до конца, необходимо, чтобы часть ионов оказалась связанной в трудно растворимый осадок.

Использованные оборудование и реактивы: Металлический штатив, штатив для пробирок, таблица растворимости, пробирки. Свежеприготовленные растворы фенолфталеина, сульфата меди (II) (2 %), хлорида калия (2 %), сульфата алюминия (2 %), гидроксида натрия (10%),хлорида бария (2 %), сульфита натрия (2 %), азотной кислоты (1:3), серной кислоты (1:5). Для выполнения работы мы приготовили оборудование Металлический штатив, штатив для пробирок, таблица растворимости, пробирки; и необходимые реактивы. Свежеприготовленные растворы сульфата меди (II) (2 %), хлорида калия (2 %), сульфата алюминия (2 %), гидроксида натрия (10%), фосфата натрия (2 %), хлорида бария (2 %), сульфита натрия (2 %), азотной кислоты (1:3), серной кислоты (1:5), фенолфталеина.
Фигуры, фото и видео химических опытов с растворами электролитов авторские, Учителя химии Феоктистовой Т.И. 2014 год Источники информации

Na2СO3 + 2HNO3 = Выделение оксида углерода (IV) бесцветного газа без запаха, вызывающего помутнение известковой воды. 2NaNO3 + СO2↑ + H2O 2Na+ + СO32-+ 2H+ + 2NO3- = 2Na+ + 2NO3-+ СO2↑ + H2O Опыт : «Получить нитрат натрия взаимодействием карбоната натрия с раствором азотной кислоты» Наблюдаем: Для того, чтобы реакция между электролитами протекала необратимо, необходимо, чтобы часть ионов оказалась связанной в летучее соединение (газ), в слабый электролит (воду). 2H+ +СO32- = СO2↑ + H2O Задание первому варианту: К хромату калия добавьте раствор серной кислоты. Напишите уравнение реакции. Запишите наблюдения. Задание второму варианту: Получите гидроксид меди (2) из имеющихся на столе реактивов. Напишите уравнение реакции. Запишите наблюдения. Ответ учеников первого варианта: Наблюдаем оранжевое окрашивание за счет образования дихромата калия. 2K2CrO4+H2SO4= K2Cr 2O7+K2SO4+H 2O Ответ учеников второго варианта: реакцией сульфата меди (2) с гидроксидом натрия мы получили гидроксид меди (2). Наблюдаем выпадение голубого осадка. СuSO4+2 NaOH = Na2SO4 + Cu(OH )2↓ Учитель. Проверим правильность уравнения по слайду. Теперь перейдем к следующему опыту. Учитель. Какого характера соединения двухвалентной меди? Ответ учеников: Характер соединений меди (2) амфотерный. Учитель: Что значит амфотерный характер вещества? Ответ учеников: Амфотерные вещества растворяются и в кислотах, и в щелочах. Демонстрация опыта в вытяжном шкафу: Прильем к гидроксиду меди (2) раствор аммиака до полного растворения осадка гидроксида меди в гидроксиде аммония. Раствор окрашен в красивый насыщенный яркий синий цвет! Это образовался комплексный ион [Сu(NH3)4] +2 Учитель. Какое окрашивание дают веществам ионы двухвалентной меди? Напишите уравнение реакции растворения гидроксида меди (2) в гидроксиде аммония. Ответ учеников: Голубое и синее окрашивание. Cu(OH)2 ↓ + 4NH4ОН= [Cu(NH3)4](OH)2 + 4H 2O

Реакция между растворами электролитов протекает до конца, если часть ионов оказывается связанной в газообразное соединение. 2H+ +СO32- = СO2↑ + H2O

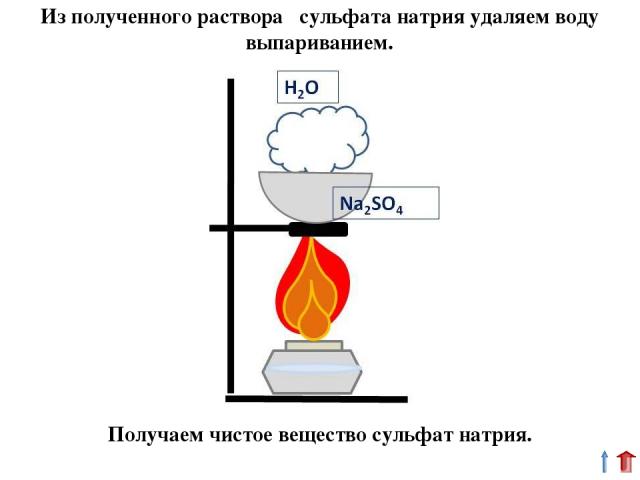
Из полученного раствора сульфата натрия удаляем воду выпариванием. Получаем чистое вещество сульфат натрия.
Чтобы реакция между электролитами протекала до конца, необходимо, чтобы часть ионов оказалась связанной в слабый электролит (воду) H+ + OH- = H2O Реакции нейтрализации (между кислотой и основанием) всегда протекают до конца!