Презентация на тему: Карбоновые кислоты

Карбоновые кислоты
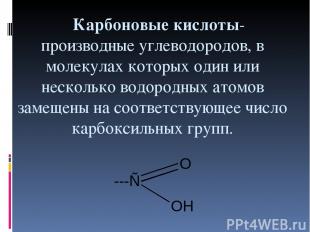
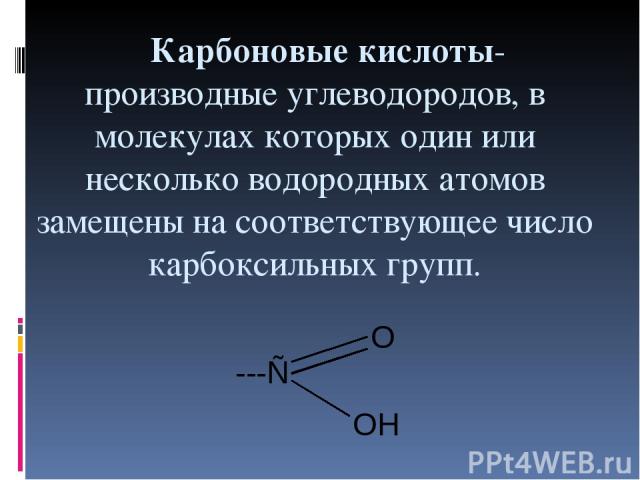
Карбоновые кислоты- производные углеводородов, в молекулах которых один или несколько водородных атомов замещены на соответствующее число карбоксильных групп.
Классификация карбоновых кислот

1. В зависимости от природы углеводного радикала а) предельные б) непредельные пропановая кислота акриловая кислота в) ароматические бензойная кислота Классификация карбоновых кислот

2. По числу атомов углерода в радикале а) низшие муравьиная кислота б) высшие α-линоленовая кислота

3. По количеству карбоксильных групп а) одноосновные уксусная кислота б) двухосновные лимонная кислота малоновая кислота в) многоосновные

Общая формула гомологического ряда одноосновных предельных карбоновых кислот

Строение карбоксильной группы

Мезомерный эффект карбоксильной группы δ+ δ-
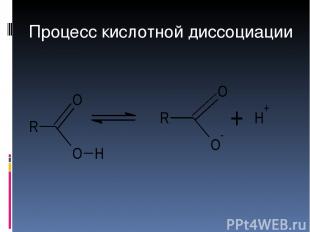
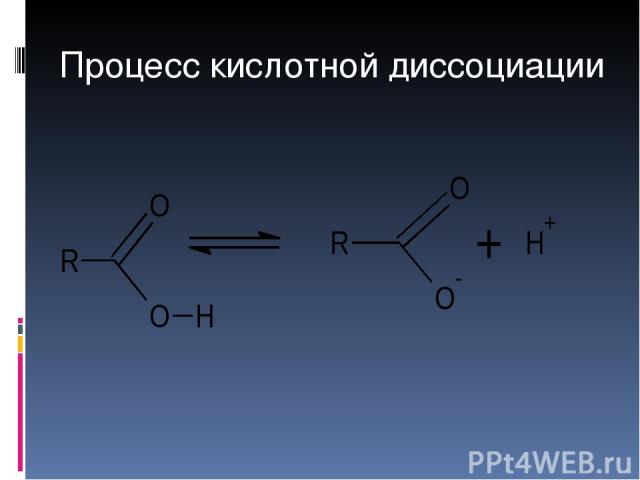
Процесс кислотной диссоциации

Индуктивный эффект карбоксильной группировки δ+ δ- - I индуктивный эффект Электроноакцепторные заместители Hal, NO2-, OH-, C6H5-, CH2=CH-.
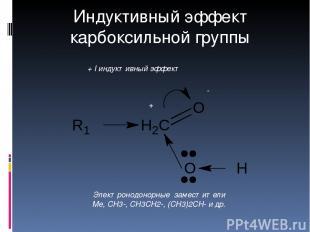
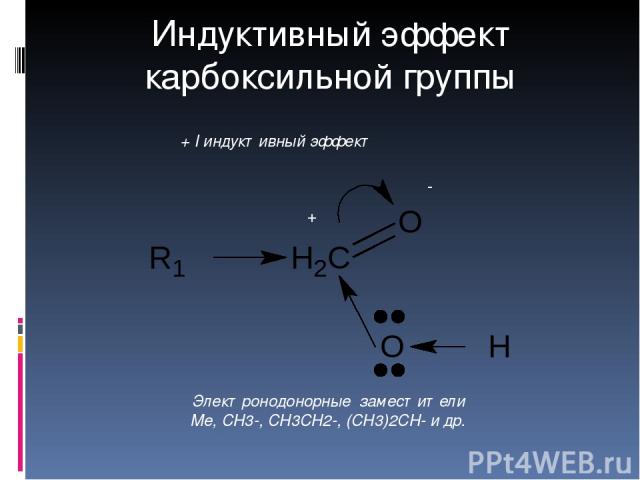
δ+ δ- + I индуктивный эффект Электронодонорные заместители Me, CH3-, CH3CH2-, (CH3)2CH- и др. Индуктивный эффект карбоксильной группы
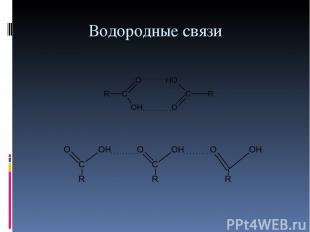
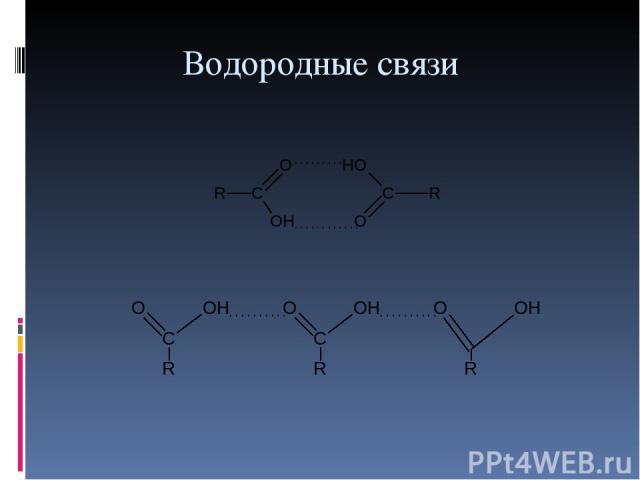
Водородные связи

Номенклатура карбоновых кислот 1 2 3 4
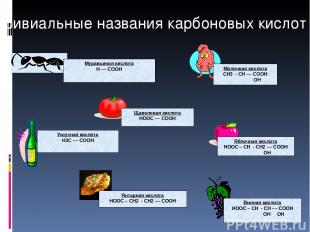
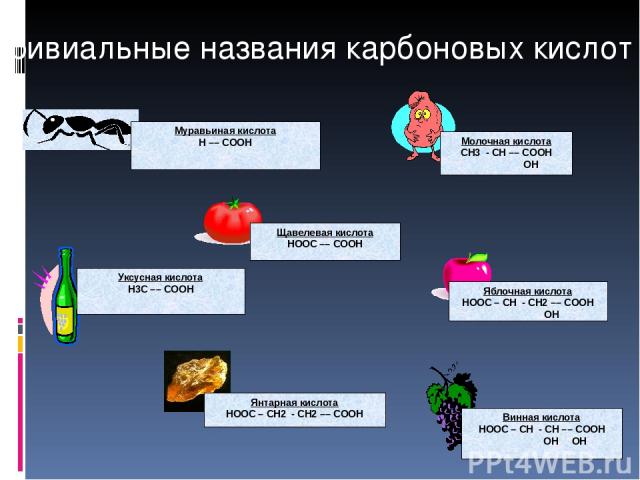
Тривиальные названия карбоновых кислот Щавелевая кислота HOOC –– COOH Уксусная кислота H3C –– COOH Молочная кислота СН3 - СН –– COOH ОН Муравьиная кислота Н –– COOH Винная кислота HOOC – СН - СН –– COOH ОН ОН Янтарная кислота HOOC – СН2 - СН2 –– COOH Яблочная кислота HOOC – СН - СН2 –– COOH ОН

Тривиальные названия карбоновых кислот Используются как лекарственные препараты

Изомерия карбоновых кислот

1. Изомерия углеродного скелета масляная кислота изомасляная кислота I. Структурная изомерия Изомерия карбоновых кислот
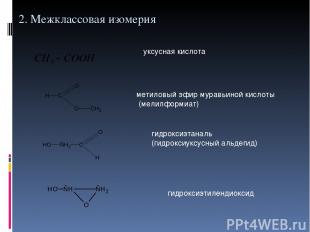
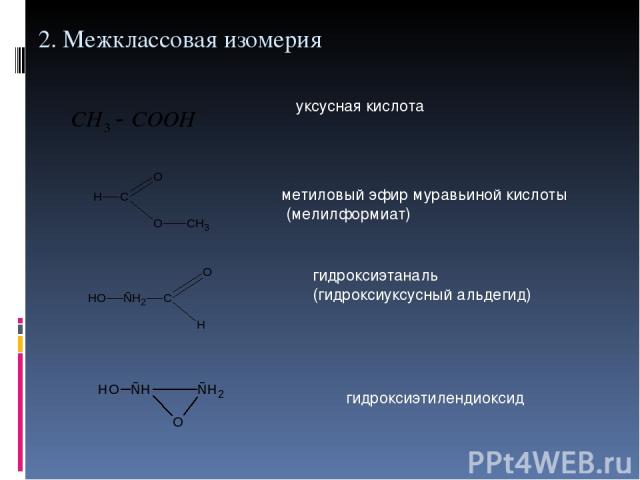
2. Межклассовая изомерия уксусная кислота метиловый эфир муравьиной кислоты (мелилформиат) гидроксиэтаналь (гидроксиуксусный альдегид) гидроксиэтилендиоксид
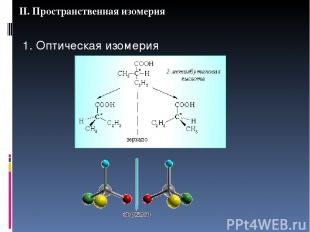
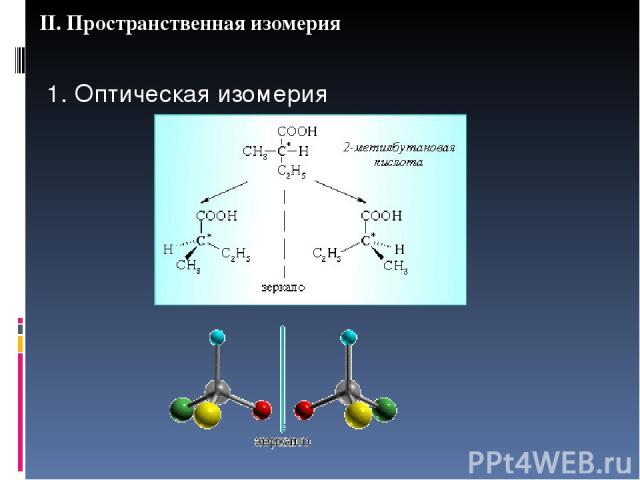
II. Пространственная изомерия 1. Оптическая изомерия
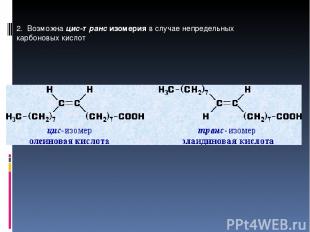
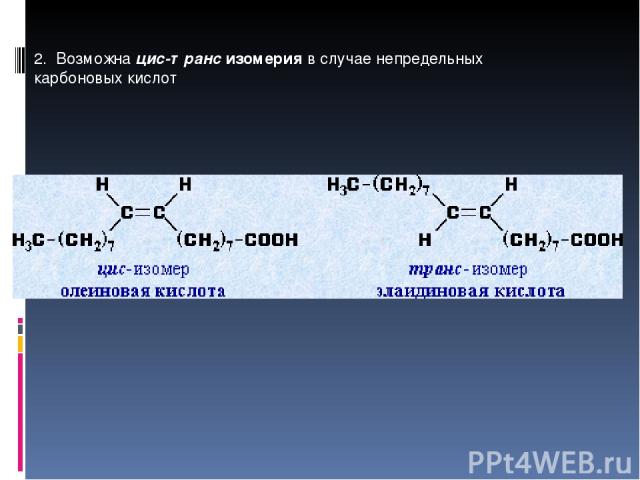
2. Возможна цис-транс изомерия в случае непредельных карбоновых кислот
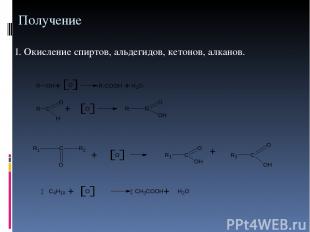
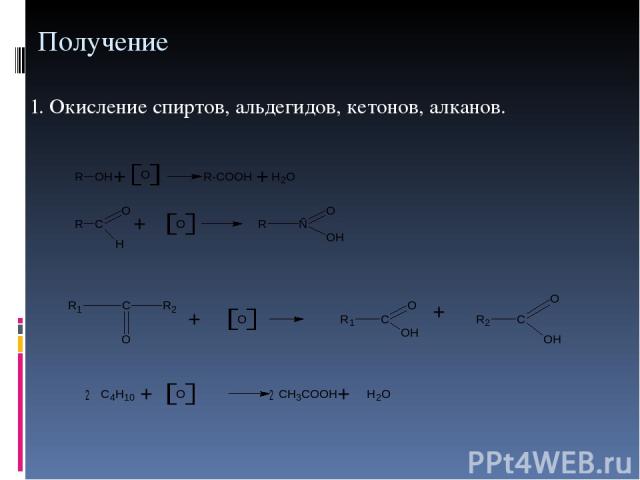
Получение 1. Окисление спиртов, альдегидов, кетонов, алканов.

2. Гидролиз нитрилов 3. Гидролиз тригалогенпроизводных

4. Щелочной и кислотный гидролиз сложных эфиров и солей 5. Оксосинтез

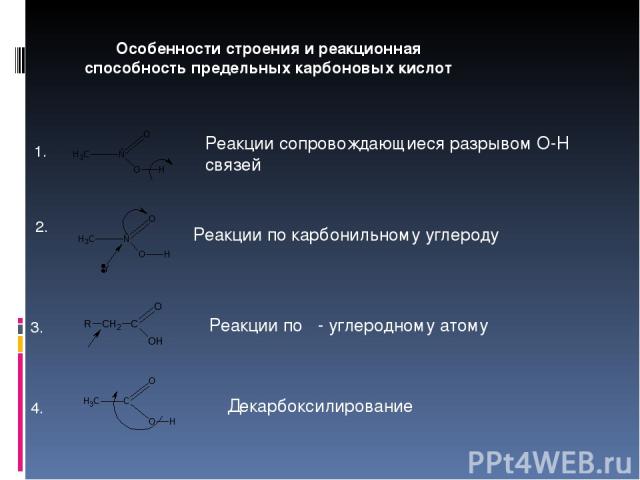
Особенности строения и реакционная способность предельных карбоновых кислот 1. Реакции сопровождающиеся разрывом О-Н связей 2. Реакции по карбонильному углероду 3. Декарбоксилирование 4. Реакции по α- углеродному атому
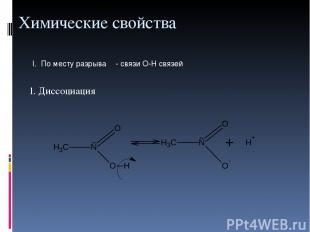
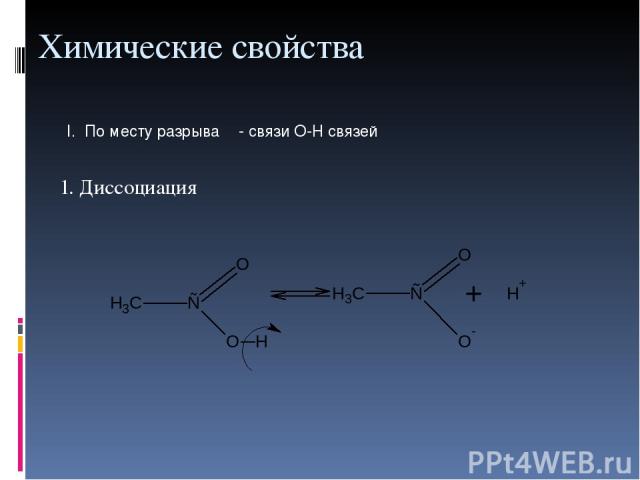
Химические свойства 1. Диссоциация I. По месту разрыва σ- связи О-Н связей

2. Взаимодействие с металлами 3. Взаимодействие с оксидами металлов 4. Взаимодействие с основаниями
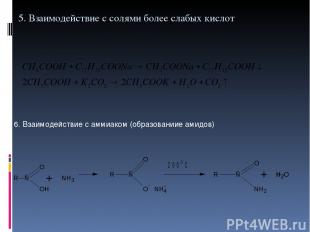
5. Взаимодействие с солями более слабых кислот 6. Взаимодействие с аммиаком (образованиие амидов)

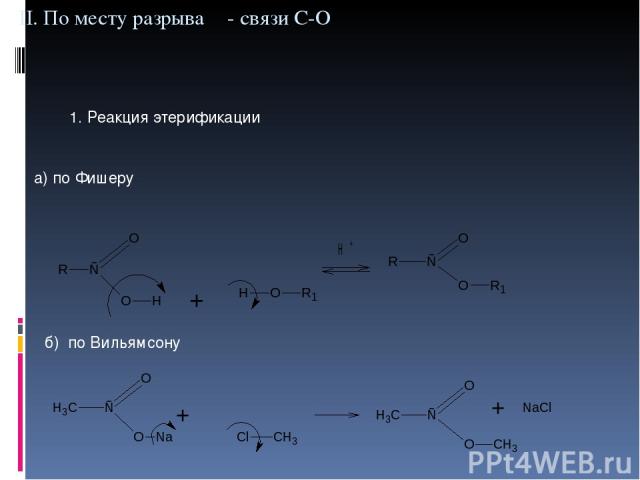
II. По месту разрыва σ- связи С-О 1. Реакция этерификации а) по Фишеру б) по Вильямсону
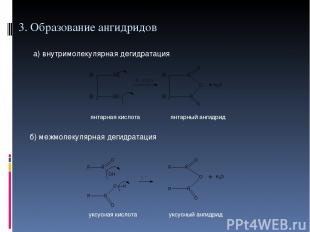
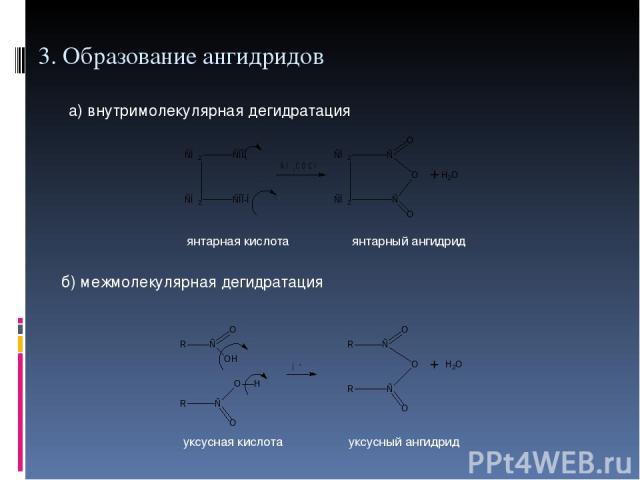
3. Образование ангидридов а) внутримолекулярная дегидратация б) межмолекулярная дегидратация янтарная кислота янтарный ангидрид уксусная кислота уксусный ангидрид
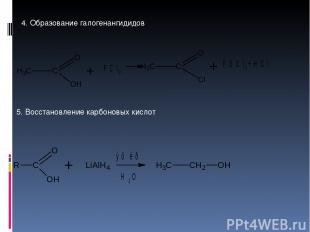
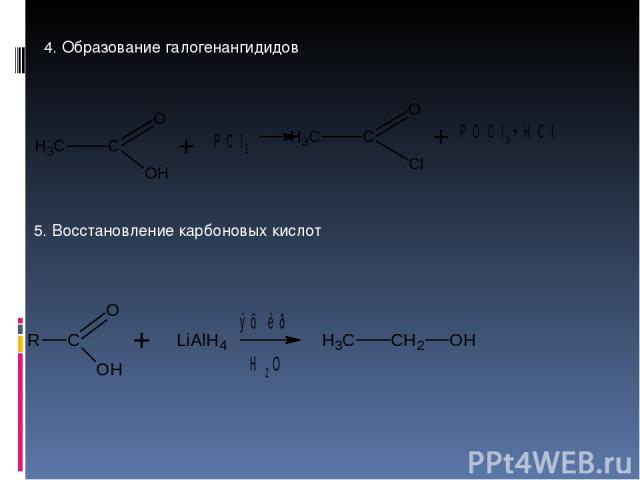
4. Образование галогенангидидов 5. Восстановление карбоновых кислот

III. По радикалу 1. Хлорирование предельных карбоновых кислот hυ, t 2. Присоединение галогеноводорода к непредельным карбоновым кислотам δ+ δ+ δ-

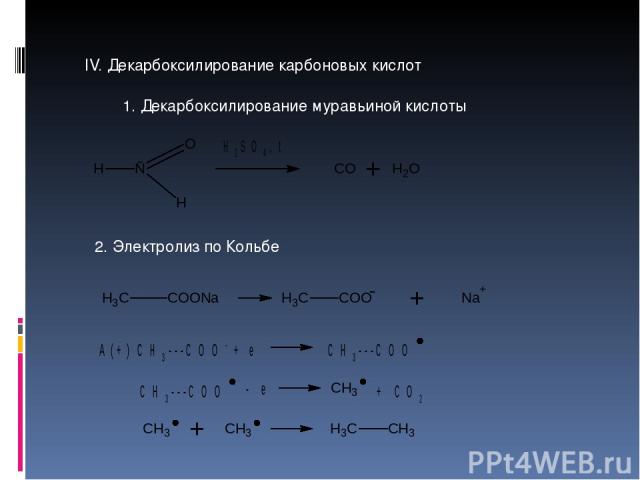
IV. Декарбоксилирование карбоновых кислот 1. Декарбоксилирование муравьиной кислоты 2. Электролиз по Кольбе