Презентация на тему: Использование ИКТ на уроках химии

«Скажи мне – я забуду. Покажи мне – я могу запомнить. Позволь мне сделать самому это – и это станет моим навсегда» Максимова С.С. МБОУ «Лудонская основная общеобразовательная школа», учитель химии 900igr.net

интересным, познавательным, обязан учитывать интересы учащихся, оставлять некоторую недосказанность и побуждать к творчеству, чтобы ребятам хотелось с интересом и увлечением раскрывать новые тайны предмета.

-- тщательно продуманную модель учебного процесса, отражающую четко сформированный методический замысел и спланированный конечный результат; -- специально методически обработанное (преобразованное) в соответствии с замыслом химическое содержание; -- систему методов и средств обучения химии, ориентированную на реализацию содержания с целью развития мышления обучаемых, учета их интересов и потребностей, обладающую свойством инвариативности, т.е. воспроизводимую в сходных условиях школьной деятельности, минимально зависимую от индивидуальности учителя. При всем этом важно, чтобы организация обучения создавала ситуацию успеха; - достаточно точный временной режим; - диагностику достигнутости промежуточных и конечного результата.

- по организационным формам ( коллективный способ обучения, групповое обучение, индивидуализированное обучение и пр.); - по доминирующему методу обучения (программированное обучение, модульное обучение, обучение на основе опорных схем-конспектов, игровое обучение, обучение на основе соревнования, опережающее обучение и пр.); - по адресной направленности (для одаренных детей, для трудных детей, для классов коррекции и т.д.); - по характеру общения между учителем и учеником (технология сотрудничества, личностно-ориентированная и т.п.).

При использовании информационных технологий перед учителем встают задачи: Создание атмосферы заинтересованности каждого ученика в работе класса. Стимулирование учащихся к высказываниям, использованию различных способов выполнения заданий без боязни ошибиться и т. п. Использование в ходе урока дидактического материала, позволяющего ученику выбирать наиболее значимые для него вид и форму учебного содержания. Оценка деятельности ученика не только по конечному результату (правильно-неправильно), но и по процессу его достижения. Поощрение стремления ученика находить свой способ работы (решения задачи), анализировать способы работы других учеников в ходе урока, выбирать и осваивать наиболее рациональные. Создание педагогических ситуаций общения на уроке, позволяющих каждому ученику проявлять инициативу, самостоятельность, избирательность в способах работы; создание обстановки для естественного самовыражения ученика.

Существуют конкретные технологии проведения мультимедийных занятий. Одна из этих технологий - урок презентация. Презентация - форма подачи материала в виде слайдов, на которых могут быть представлены таблицы, схемы, рисунки, иллюстрации, аудио- и видиоматериалы.

Мультимедийный урок-презентация имеет значительные преимущества в том, что информация в нем преподносится: - графически выразительно (легче запоминается и понимается); - в сочетании с изображением, текстом и звуком ( эмоционально воспринимается); - любым объемом (сообразно конкретным потребностям учебного процесса).

Струго-Красненский район МБОУ Лудонская основная общеобразовательная школа Учитель: Максимова Светлана Сергеевна

Последовательность действий Написать уравнение химической реакции. 2. Данные из условия задачи записать над уравнением реакции. 3. Под формулами написать а) количество вещества (n) б) молярную массу (M) в) массу вещества, исходя из формулы m= M · n 4. Составить пропорцию Решить пропорцию 6. Записать ответ Решение задачи 1. CaO + H2O =Ca (OH)2 X г 37 г 2. CaO + H2O =Ca (OH)2 Хг 37г 3. СaO + H2O =Ca (OH)2 1 моль 1 моль 56г/моль 74г/моль 56г 74г 4. Х = 37 56 74 х= 56·37:74 = 28г Для получения гидроксида кальция массой 37г потребуется оксид кальция массой 28г.

Хг 37г СaO + H2O =Ca (OH)2 1 моль 1 моль 56г/моль 74г/моль 56г 74г Х = 37 56 74 х= 56·37:74 = 28г

Выучить алгоритм решения задач по уравнениям реакции; Придумать условие задачи подобное , решенным в классе и решить ее


H2OKNa2CO3HClMgSO4ClBa2SO3NaOHH2SHNO3RbPCO3Ba(NO3)2PO4CuCl2NaKCaSO4PbOKClO3Cl2ONO3Fe2O3SCaHPO4SiO2BaCO3CuSO4F2CO3PbCl2HICrO3CCH3COOHLiHCO3WK2OFeSZnBr2 NH4OHN2O3RbHSO4Mg
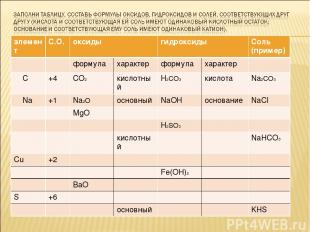
элемент С.О. оксиды гидроксиды Соль (пример) формула характер формула характер С +4 СО2 кислотный Н2СО3 кислота Na2CO3 Na +1 Na2O основный NaOH основание NaCl MgO H2SO3 кислотный NaHCO3 Cu +2 Fe(OH)2 BaO S +6 основный KHS


Историческая справка. 375 лет назад итальянский ученый химик, врач Анджело Сала получил серную кислоту, сжигая серу под стеклянным колоколом в присутствии водяного пара.