Презентация на тему: Аммиак и соли аммония

Аммиак и соли аммония

Цели урока: Рассмотреть строение молекулы аммиака и солей аммония;Познакомиться с физическими свойствами, способами получения, распознавания аммиака и солей аммония;Изучить химические свойства веществ.

Строение молекулы аммиака Электронная формула:Структурная формула: H N H H

Физические свойства аммиака: Аммиак NH3 – газ без цвета, с резким запахом, почти в два раза легче воздуха, хорошо растворим в воде: в 1 объеме воды растворяется 710 объемов газа. Причина: образование водородных связей.Водородная связь – связь между атомами водорода одной молекулы и атомами очень электроотрицательного элемента, имеющего свободные электронные пары, другой молекулы (N, F, O) H H H H H N … H N … H N H N … H O H H H H H водородные связи межну молекулами аммиака водородные связи между молекулой аммиака и воды

Химические свойства аммиака C водой: NH3 + H2O NH3 * H2OС кислотами: Горит : NH3 + О2 = N2 + H2O NH3 + О2 = NO + H2O ( с катализатором)Задание : расставьте коэффициенты методом электронного балансаNH3 + HC1 = NH4C1 NH3 + HN03 = NH4N03 NH3 + H2S04 = NH4HS04 или 2NH3 + H2S04 = (NH4)2S04

Получение и распознавание аммиака В промышленности: N2 + H2 NH3 В лаборатории: Ca(OH)2 + NH4CL = CaCL2 + H2O +NH3 распознавание – тремя способами: - по запаху; - по посинению влажной индикаторной бумажки (почему?) - по появлению белого дыма от поднесенной стеклянной палочки , смоченной соляной кислотой (почему?)
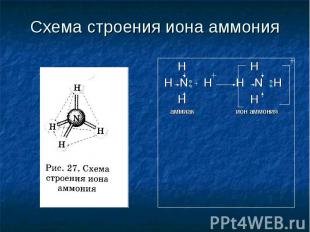
Схема строения иона аммония H H H N + H H N H H H аммиак ион аммония

Соли аммония Сложные вещества, состоящие из катионов аммония и анионов кислотного остаткаПо физическим свойствам похожи на соли щелочных металлов (особенно на соли калия) т.к. радиусы ионов калия и аммония близки по размерам.Твердые кристаллические вещества белого цвета, хорошо растворимые в воде.Применяются: - в качестве азотных удобрений; - аммиачная селитра NH4NO3 используется в смеси с алюминием для приготовления взрывчатки (аммонала); - нашатырь NH4CL применяется при паянии; - гидрокарбонат аммония NH4HCO3 - разрыхлитель теста при хлебопечении.

Свойства солей аммония Разлагаются при нагревании: NH4CL = NH3 + HCL NH4HCO3 = NH3 + H2O + CO2 NH4NO3 = N2O + 2H2O NH4NO2 = N2 + H2OКачественная реакция на ион аммония: NH4CL + NaOH = NH3 + H2O + NaCL





















