Презентация на тему: Химия цвета

Презентация к интегрированному уроку (ИЗО, химия) по теме «ХИМИЯ и ЦВЕТ» для обучающихся 8 класса Химия цвета Автор презентации: Цыганкова Ольга Викторовна учитель химии МОУ Шебертинская СОШ
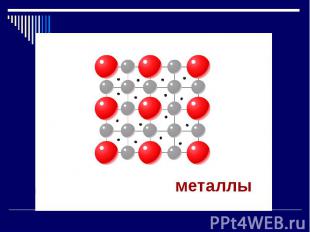
металлы
Неорганические вещества
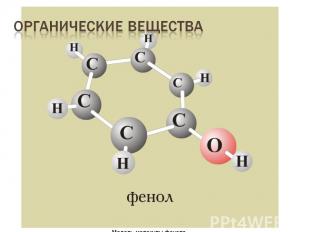
Органические вещества

Спектральный анализ Техника выполнения опыта. Смочите кусочки фильтровальной бумаги растворами солей натрия, калия, лития, кальция. Закрепите эти кусочки на ушко медной проволочки и вносите поочерёдно в пламя.

Соли щелочных металлов окрашивают пламя в характерные для каждого из них цвета. Соль натрия, внесенная в пламя, окрашивает его в желтый цвет, калия -- в фиолетовый, кальция -- в кирпично-красный, лития -- в карминово-красный.Это свойство солей используется для идентификации солей и при изготовлении фейерверков и сигнальных ракет.
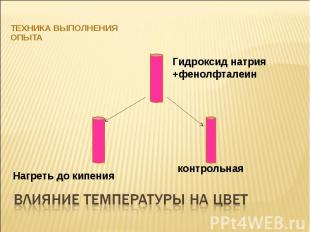
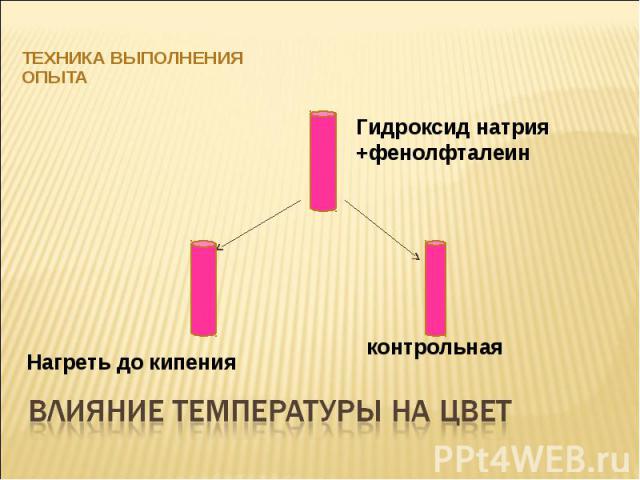
Техника выполнения опыта Гидроксид натрия +фенолфталеин Нагреть до кипения контрольная Влияние температуры на цвет

Константа диссоциации воды сильно зависит от температуры. В разбавленных растворах щелочи [OH-] не изменяется при нагревании, в то время как [H+] увеличивается. Поэтому фенолфталеин, имеющий интервал перехода окраски при нагревании обесцвечивается, так как среда становится менее щелочной.
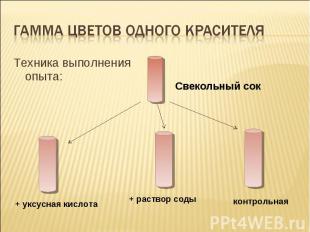
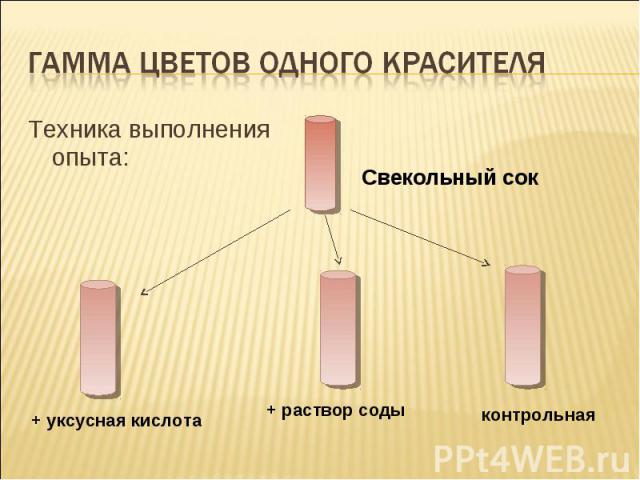
Гамма цветов одного красителя Техника выполнения опыта: Свекольный сок + уксусная кислота + раствор соды контрольная

пояснение Сок обыкновенной красной свеклы может служить в качестве примера зависимости цвета природных красителей от кислотности среды. В первом случае среда кислая – цвет раствора пурпурный. Во втором –раствор голубоватый, т.к. среда щелочная. В нейтральном растворе цвет красителя бордово-коричневый и возможно выпадение хлопьев.
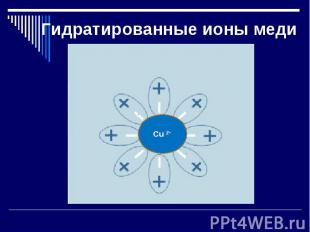
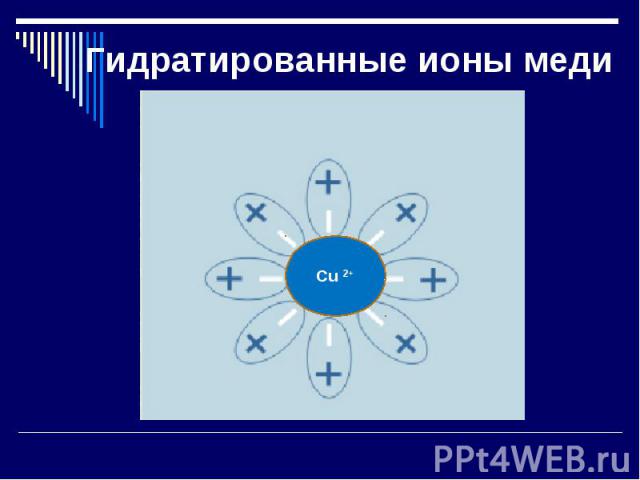
Гидратированные ионы меди
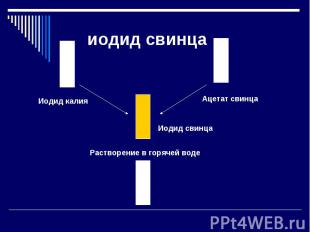
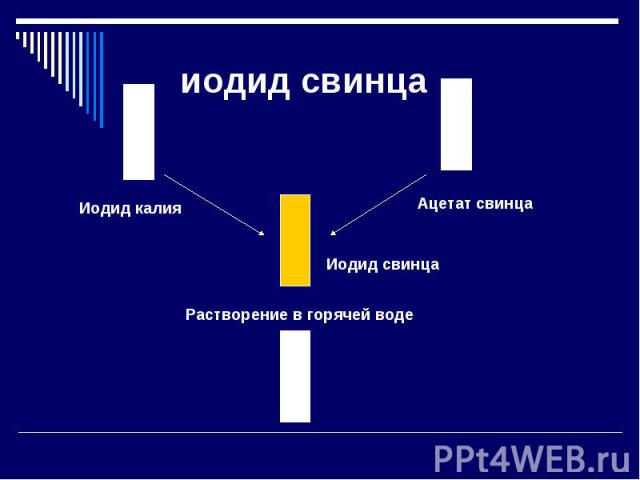
иодид свинца Иодид калия Растворение в горячей воде Иодид свинца Ацетат свинца

пояснение Pb2+ и I-. Оба иона в водном растворе бесцветны. Когда ионы сближаются друг с другом и выпадает золотисто-желтый осадок кристаллов PbI2. Исчезновение окраски при растворении в горячей воде объясняется тем, что вещество распадается на отдельные ионы, каждый из которых бесцветен.





![Константа диссоциации воды сильно зависит от температуры. В разбавленных растворах щелочи [OH-] не изменяется при нагревании, в то время как [H+] увеличивается. Поэтому фенолфталеин, имеющий интервал перехода окраски при нагревании обесцвечивается, … Константа диссоциации воды сильно зависит от температуры. В разбавленных растворах щелочи [OH-] не изменяется при нагревании, в то время как [H+] увеличивается. Поэтому фенолфталеин, имеющий интервал перехода окраски при нагревании обесцвечивается, …](https://fs1.ppt4web.ru/images/4134/59935/640/img7.jpg)