Презентация на тему: Соль азотной кислоты

Соли азотной кислоты, применение Девиз урока «Au, Na, Ar, Ne, It, Eu – Os, Ra,U, Db, In, Er, As Ni, Es C, Eu La Ь» Л. Н. Толстой 900igr.net

знать и уметь называть соли азотной кислоты, определять какие свойства окислительные или и восстановительные характерны для них; определять: степень окисления химических элементов в формулах солей; типы химических реакций, в которых они могут участвовать; характеризовать: общие хими ческие свойства солей азотной кислоты;

Игра «КРЕСТИКИ- НОЛИКИ Раствор азотной кислоты реагирует с каждым из веществ. MgO Al P2O5 KCl CO2 CaCO3 Al2O3 K2SiO3 Zn

К каким классам неорганических веществ принадлежат эти вещества? 1.Назовите соли - продукты этих реакций 2. Составьте в тетради молекулярные уравнения реакций получения нитратов. MgO Al P2O5 KCl CO2 CaCO3 Al2O3 K2SiO3 Zn

Закончите уравнения реакций и объясните, какие классы соединений при взаимодействии могут давать нитраты. ВаО + НNO3→ ВаО + N2О5 → Ba(NO3)2 + Na2SO4 →

Даны пары веществ, составьте возможные уравнения реакций а) гидроксид натрия и азотная кислота, б) гидроксид калия и оксид азота (V), в) оксид кальция и азотная кислота, г) аммиак и азотная кислота, д) сульфат бария и нитрат кальция, е) хлорид натрия и нитрат бария, Какие из реакций невозможны и почему?

Перечислите соли полученные в результате возможных реакций. Нитраты калия, натрия, кальция и аммония называют селитрами KNO3 – нитрат калия (индийская селитра), NаNО3 – нитрат натрия (чилийская селитра), Са(NО3)2 – нитрат кальция (норвежская селитра) NH4NO3 – нитрат аммония (аммиачная или аммонийная селитра, ее месторождений в природе нет). Германская промышленность считается первой в мире, получившей соль NH4NO3 из азота N2 воздуха и водорода воды, пригодную для питания растений.

Нитраты – твердые кристаллические вещества, тугоплавки, определите по таблице растворимости, к каким электролитам они относятся - сильным или слабым?

Физические свойства нитратов Какие вещества называют солями? Нужно построить логическую цепочку: вид химической связи – тип кристаллической решетки – силы взаимодействия между частицами в узлах решетки – физические свойства веществ.

Химические свойства нитратов Взаимодействие нитратов с металлами, кислотами, щелочами, солями Cu(NO3)2 + Zn … , AgNO3 + HCl … , Cu(NO3)2 + NaOH … , AgNO3 + BaCl2 … .

Занимательная история Любознательный химик изучил типы химических реакций и заметил, что нерастворимые карбонаты (CaCO3) , сульфиты (CaSO3) , силикаты (CaSiO3) , некоторые сульфаты (FeSO4) разлагаются при нагревании. Он поставил перед собой задачу, определить будут ли разлагаться нитраты. Для опыта он взял лабораторный штатив, пробирку с нитратом натрия, спиртовку. Зная, что при разложении многих солей образуется газ, любознательный химик приготовил лучину, лакмусовую бумажку и известковую воду (Са(ОН)2). Когда соль нагрелась и расплавилась, он опустил в пробирку тлеющую лучину, она внезапно вспыхнула. К каким выводам пришел юный химик?

Что получается при разложении нитрата натрия? NaNO3 → ? + ?

После первого опыта юный химик решил проверить, как будут разлагаться другие соли, например, нитрат меди(II) , нитрат серебра. При разложении нитрат меди(II) образовалось вещество (А) черного цвета и выделился газ (В) бурого цвета. Cu(NO3)2 → А + В +? Составьте уравнение реакции разложения этой соли, применяя закон сохранения массы вещества. Укажите окислитель, восстановитель.

Cu(NO3)2 → А + В +? Cu(NO3)2 → … + ...+ … Атомы в нитрате Cu N O Число атомов исходных веществ 1 2 6 Число атомов продуктов реакции Составьте схемы электронного баланса реакции разложения соли

Разложение нитрата меди (II)

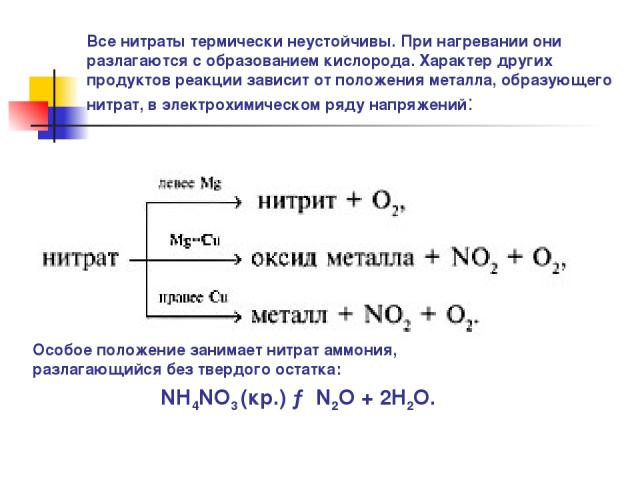
Все нитраты термически неустойчивы. При нагревании они разлагаются с образованием кислорода. Характер других продуктов реакции зависит от положения металла, образующего нитрат, в электрохимическом ряду напряжений: Особое положение занимает нитрат аммония, разлагающийся без твердого остатка: NH4NO3 (кр.) → N2O + 2H2O.