Презентация на тему: Соединения фосфора

Соединения фосфора Оксид фосфора (V) 1. Состав. Строение 3. Химические свойства Фосфорная кислота 1. Состав. Строение. Свойства 2. Классификация 3. Химические свойства Соли фосфорной кислоты Применение соединений фосфора Тест 2.Физические свойства 900igr.net
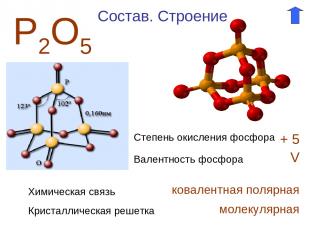
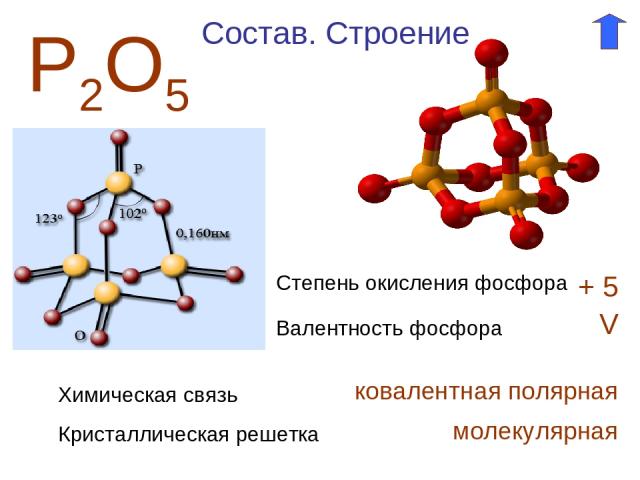
Р2О5 Степень окисления фосфора + 5 Валентность фосфора V Состав. Строение Химическая связь ковалентная полярная Кристаллическая решетка молекулярная

Физические свойства оксида фосфора (V) Оксид фосфора (V), или фосфорный ангидрид, Р2О5 – белый рыхлый порошок. Это очень гигроскопичное вещество, которое эффективно используется для осушения газов.

Химические свойства оксида фосфора (V) К какой группе оксидов относится оксид фосфора (V) ? Оксид фосфора (V) кислотный оксид Какие свойства характерны для кислотных оксидов? Взаимодействие с водой, основными оксидами, основаниями. Составьте уравнения реакций оксида фосфора (V) c водой, оксидом кальция, гидроксидом натрия. Реакции обмена рассмотрите с т. зр. ТЭД
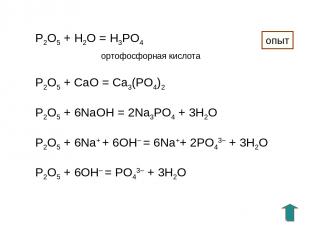
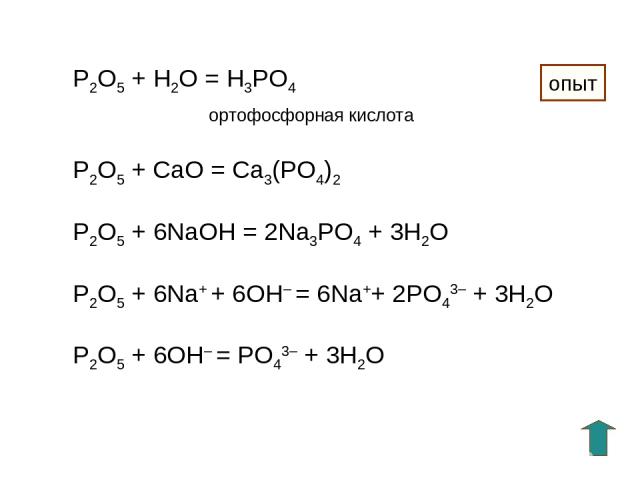
P2O5 + H2O = H3PO4 ортофосфорная кислота P2O5 + СaO = Ca3(PO4)2 P2O5 + 6NaOH = 2Na3PO4 + 3H2O P2O5 + 6Na+ + 6OH– = 6Na++ 2PO43– + 3H2O P2O5 + 6OH– = PO43– + 3H2O опыт

Получение фосфорной кислоты
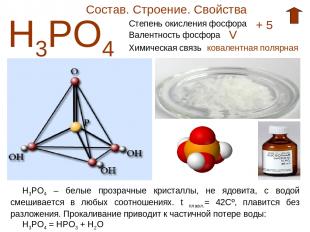
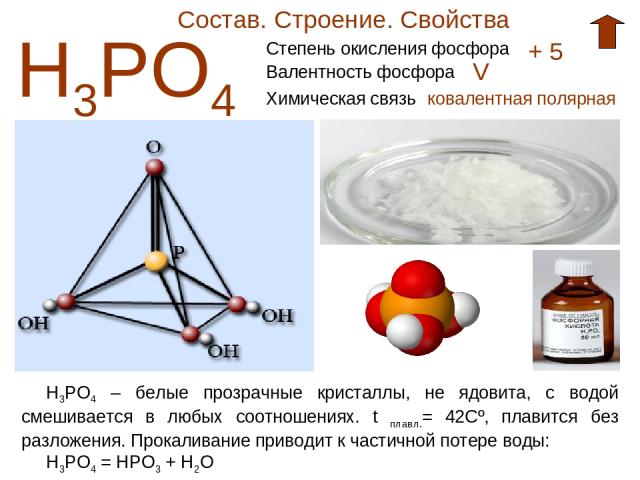
Состав. Строение. Свойства Н3РО4 Степень окисления фосфора + 5 Валентность фосфора V Химическая связь ковалентная полярная Н3РО4 – белые прозрачные кристаллы, не ядовита, с водой смешивается в любых соотношениях. t плавл.= 42Cº, плавится без разложения. Прокаливание приводит к частичной потере воды: Н3РО4 = НРО3 + Н2О

Фосфорная кислота (H3РO4). Классификация Фосфорная кислота по: наличию кислорода: основности: растворимости в воде: летучести: степени электролитической диссоциации: стабильности: кислородсодержащая трехосновная растворимая нелетучая средней силы стабильная

Химические свойства Фосфорная кислота проявляет все свойства кислот Опишите химические свойства фосфорной кислоты 1) со щелочами: NaOH, KOH 2) с основными оксидами: Li2O, Na2O 3) с солями: Na2CO3 Лабораторный опыт «Качественная реакция на фосфат-ион» 4) с металлами

Взаимодействие фосфорной кислоты со щелочами: H3PO4 + 3NaOH = Na3PO4 + 3H2O 3H+ + PO43– + 3Na+ + 3OH– = 3Na+ + PO4 3– + 3H2O H+ + OH– = H2O H3PO4 + 3KOH = K3PO4 + 3H2O 3H+ + PO43– + 3K+ + 3OH– = 3K+ + PO4 3– + 3H2O H+ + OH– = H2O

Взаимодействие фосфорной кислоты с основными оксидами: 2H3PO4 + 3Na2O = 2Na3PO4 + 3H2O 6H+ + 2PO43– + 3Na2O = 6Na+ + 2PO4 3– + 3H2O 6H+ + 3Na2O = 6Na+ + 3H2O 2H3PO4 + 3Li2O = 2Li3PO4 + 3H2O 6H+ + 2PO43– + 3Li2O = 6Li+ + 2PO4 3– + 3H2O 6H+ + 3Li2O = 6Li+ + 3H2O

Взаимодействие фосфорной кислоты с солями: 2H3PO4 + 3Na2CO3 = 2Na3PO4 + 3CO2 +3H2O 2H+ + CO32– = H2O + CO2 6Н+ + PО43– + 6Nа+ + CO32– = 6Nа+ + PO43– + 3CO2+ 3H2O

Качественная реакция на фосфат-ион Лабораторный опыт: Налейте в пробирку 1 мл раствора фосфата натрия и добавьте к нему такой же объем нитрата серебра. Что происходит? Напишите уравнение реакции. Na3PO4 + 3AgNO3 = Ag3PO4 + 3NaNO3 Ag+ + PO43– = Ag3PO4

Взаимодействие фосфорной кислоты с металлами Фосфорная кислота может быть слабым окислителем только за счет ионов Н+ . При взаимодействии с активными металлами выделяется водород. Составьте уравнение реакции фосфорной кислоты с магнием. 2H3PO4 + 3Mg = Mg3(PO4)2 + 3H2 6H3PO4 + 2Al = 2Al(H2PO4)3 + 3H2

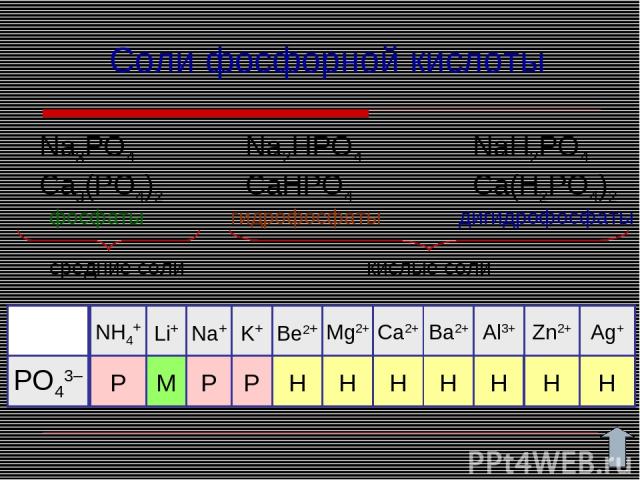
Соли фосфорной кислоты Na3PO4 Ca3(PO4)2 Na2HPO4 CaHPO4 NaH2PO4 Ca(H2PO4)2 фосфаты гидрофосфаты дигидрофосфаты средние соли кислые соли P P M P Н Н Н Н РО43– Н Н Н NH4+ Be2+ Li+ K+ Na+ Mg2+ Ca2+ Ba2+ Al3+ Zn2+ Ag+

Применение фосфорной кислоты и фосфатов 1 2 3 5 4 7 6 В пищевой промышленности как добавку к безалкогольным напиткам Фосфаты кальция входят в состав зубных паст, материалов для пломбирования зубов Фосфаты кальция входят в состав витаминных добавок для домашних животных Фосфаты натрия находят применение для защиты железных покрытий от коррозии, они входят в состав моющих и чистящих средств. Фосфаты натрия входят в состав огнеупорных красок. Производство минеральных удобрений Фосфорная кислота является катализатором в органическом синтезе

2. Будучи кислотным оксидом, оксид фосфора (V) взаимодействует: А) с водой с образованием кислоты; Б) со щелочами с образованием соли и воды; В) с основными оксидами с образованием солей; Г) все приведенные выше ответы верны. Г 1. Оксид фосфора (V) является оксидом: А) основным; Б) амфотерным; В) кислотным; Г) несолеобразующим. В 3. Обнаружить наличие фосфат-аниона в водном растворе можно при помощи: А) индикаторной бумаги; В) медной проволоки; Б) раствора гидроксида натрия; Г) раствора нитрата серебра. Г 4. Какая формула соответствует гидрофосфату кальция: А) Са3(РО4)2; Б) СаНРО4; В) Са(НРО3)2; Г) Са(Н2РО4)2 Б 5. Ортофосфорная кислота образуется при взаимодействии: А) оксида фосфора (V) с водой при нагревании; В) фосфора с водой; Б) ортофосфата калия с угольной кислотой; Г) оксида фосфора (III) c водородом А 6. В какой из приведенных пар оба вещества взаимодействуют с раствором ортофосфорной кислоты: А) сера и нитрат серебра; В) серебро и аммиак; Б) аммиак и гидроксид натрия; Г) гидроксид меди (II) и раствор хлорида натрия. Б 7. Как можно отличить разбавленную азотную кислоту от разбавленной фосфорной: А) по цвету; В) по действию на цинк; Б) по изменению цвета индикатора; Г) по реакции со щелочами. В