Презентация на тему: Соединения кремния

Кремний и его соединения 900igr.net

Нахождение в природе В природе кремний Si – второй по распространён-ности после кислорода эле-мент ( 28 0/0 от массы зем-ной коры ). Земная кора более чем на четверть состоит из его соединений. Наиболее распространён-ным соединением кремния является его диоксид SiO2, другое его название – кремнезём. Кремний в виде скелета живого организма

Разновидности кварца Диоксид кремния в природе образует минерал кварц и многие его разновидности, такие, как: горный хрусталь и его знаменитая лиловая форма – аметист; агат; опал; яшма; халцедон; сердолик. Минерал кварц Все эти минералы имеют одну и туже химическую формулу – SiO2.

Аметист Аметистовая жеода Кристалл аметиста

Горный хрусталь Перед вами статуэт-ка бульдога из горно-го хрусталя, создан-ная по замыслу юве-лира. Наиболее чистый кварц – горный хрус-таль – бесцветен и прозрачен.

Агат Агат очень интересный и удивительный камень. Его различные разновидности и оттенки (разводы, круги, пейзажи) вдохновляют мастеров и ювелиров на создание уникальных украшений и предметов. Этот минерал, являясь поделочным и полудраго-ценным камнем, широко используется в создании женских украшений и других предметов.

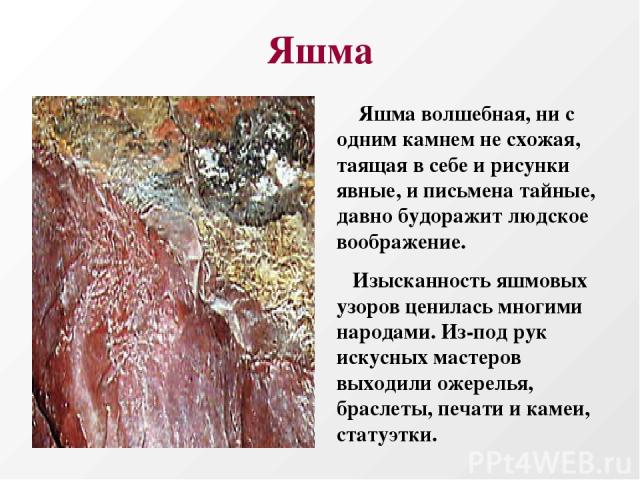
Яшма Яшма волшебная, ни с одним камнем не схожая, таящая в себе и рисунки явные, и письмена тайные, давно будоражит людское воображение. Изысканность яшмовых узоров ценилась многими народами. Из-под рук искусных мастеров выходили ожерелья, браслеты, печати и камеи, статуэтки.

Топаз Перед вами кристалл топаза, инкрустированный в горной породе.
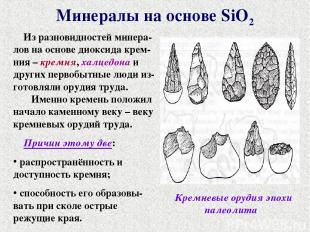
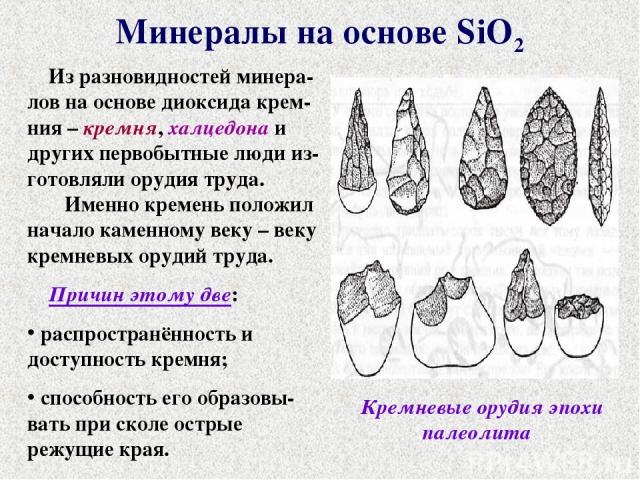
Минералы на основе SiO2 Из разновидностей минера-лов на основе диоксида крем-ния – кремня, халцедона и других первобытные люди из-готовляли орудия труда. Именно кремень положил начало каменному веку – веку кремневых орудий труда. Причин этому две: распространённость и доступность кремня; способность его образовы-вать при сколе острые режущие края. Кремневые орудия эпохи палеолита

Природные силикаты Второй тип природных соедине-ний кремния – это силикаты. Они составляют 75 0/0 от массы земной коры. Среди них наиболее распространены алюмосиликаты. К ним относятся: гранит; различные виды глин; слюды; нефелин и др. Силикатом, не содержащим алюминий, является асбест. Глобус из нефелина
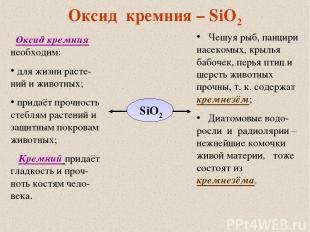
Оксид кремния – SiO2 SiO2 Оксид кремния необходим: для жизни расте-ний и животных; придаёт прочность стеблям растений и защитным покровам животных; Кремний придаёт гладкость и проч-ноть костям чело-века. Чешуя рыб, панцири насекомых, крылья бабочек, перья птиц и шерсть животных прочны, т. к. содержат кремнезём; Диатомовые водо-росли и радиолярии – нежнейшие комочки живой материи, тоже состоят из кремнезёма.

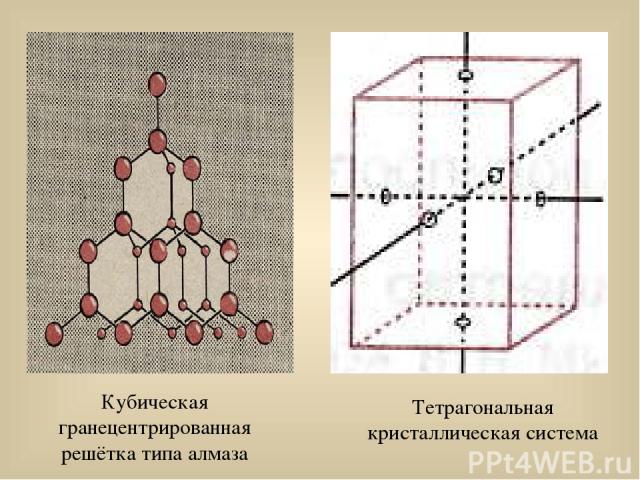
Свойства кремния Структура элементар-ного кремния аналогична алмазу. Графитоподобная модификация неизвестна. Кремний – типичный полупроводник ( при нагревании проводимость возрастает). t(Si) плавления = 1415 0С t(Si) кипения = 3249 0С Известно пять модифика- ций кремния: четыре кристаллические: (кубическая гранецентриро-ванная решётка типа алмаза, тетрагональная решётка при давлении 20 ГПа, кубичес-кая решётка при давлении более 20 ГПа, гексагональ-ная решётка); аморфная.
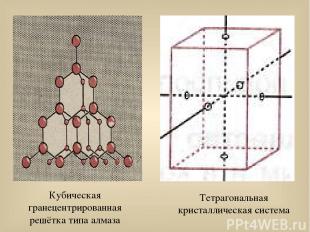
Кубическая гранецентрированная решётка типа алмаза Тетрагональная кристаллическая система
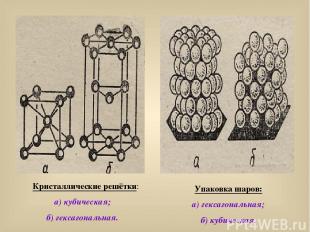
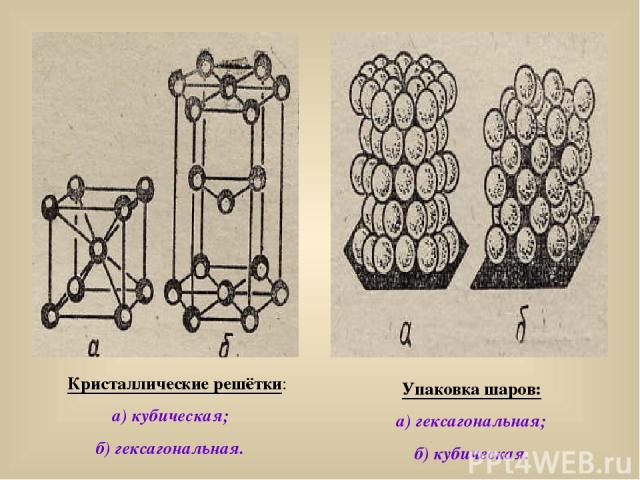
Кристаллические решётки: а) кубическая; б) гексагональная. Упаковка шаров: а) гексагональная; б) кубическая.
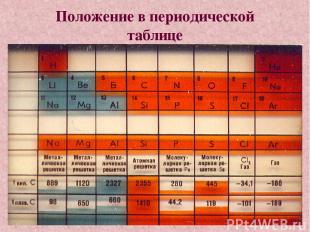
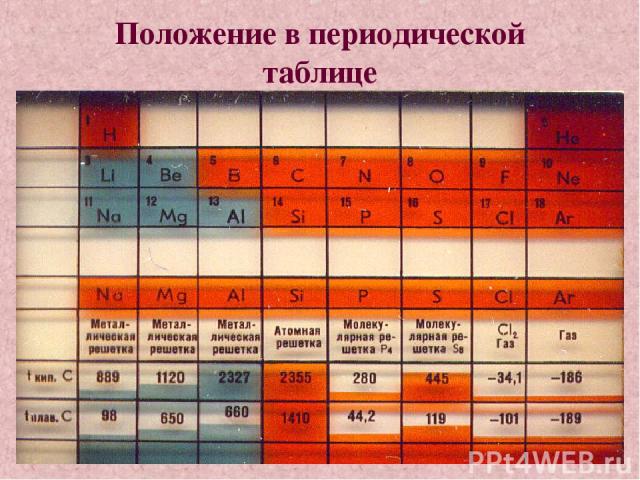
Положение в периодической таблице

Проводимость кремния увеличивается при замене некоторых атомов кремния атомами элементов сосед-них групп периодической системы Д. И. Менделеева. При замещении Si эле-ментами V группы (фосфо-ра Р, висмута Bi) усилива-ется электронная проводи-мость, при замещении элементами III группы (алюминия AL, бора В) – дырочная. Электронная конфигура-ция наружного электронного слоя кремния: … 3s23p23d0 +14Si… 3s2 3p2 3d0 Электронная конфигурация углерода: 1s22s22p2 +6С 1s2 2s2 2p2
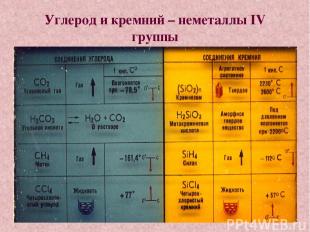
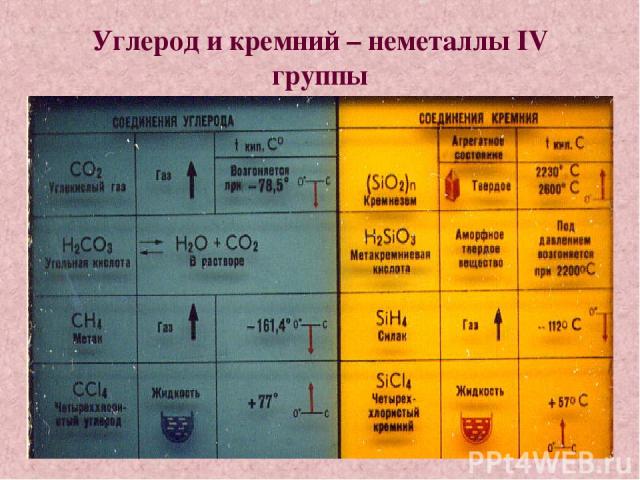
Углерод и кремний – неметаллы IV группы
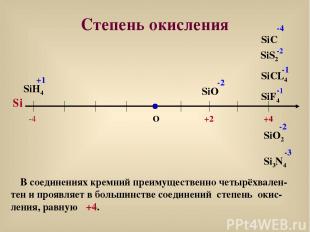
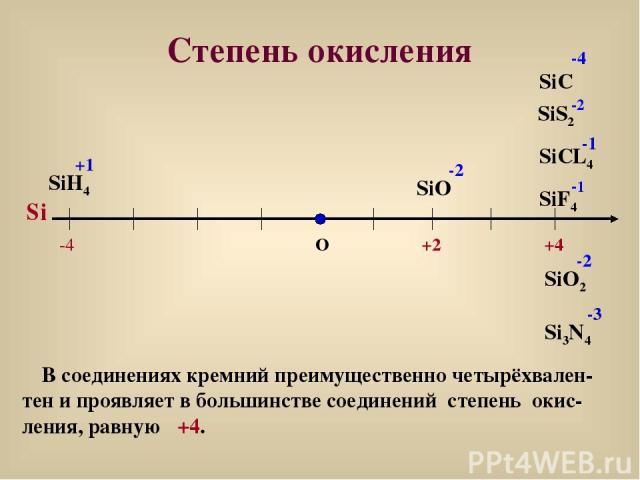
Степень окисления О +4 SiF4 -1 SiS2 -2 SiO -2 Si SiO2 -2 -4 SiH4 +1 Si3N4 -3 В соединениях кремний преимущественно четырёхвален-тен и проявляет в большинстве соединений степень окис-ления, равную +4. SiC -4 SiCL4 -1 +2

Атомы кремния способны образовывать цепочки, что является признаком кремний-органических соединений. В этом отношении он сходен с углеродом. Однако энергия связи Si – Si почти в два раза меньше, чем у связи С – С. Поэтому кремниевые цепочки ограничены максимум восемью атомами (Si8H16 – октасилан). Существенное отличие кремния от углерода состоит в неспособности атомов кремния образовывать двойные и тройные связи. Самая важная и характерная особенность кремния – способность образовывать бесконечные цепочки, слои, пространственные каркасы из фрагментов Si – O – Si. ----О----Si----O----Si----O----Si----O---- O O O ----O----Si----O----Si----O----Si----O---- SiO2 кварц

Химические свойства Si С простыми веществами: а) кремний горит в кислороде, образуя известный вам уже диоксид кремния, или оксид кремния (IV): Si + O2 = SiO2 б) будучи неметаллом, при нагревании он соединяется с металлами с образованием силицидов, например: Si + Mg = Mg2Si

в) кремний непосредственно реагирует с водородом при повышенных температурах с образованием кремнийводородов – силанов: Si + 2H2 = SiH4 (моносилан) г) при комнатной температуре лишь фтор реагирует с кремниевой пылью: Si +2F2 = SiF4

Со сложными веществами: Кремний взаимодействует с концентрированными водными растворами щелочей, образуя силикаты и водород: Si + 2NaOH + H2O = Na2SiO3 +2H2 Химические свойства соединений кремния: Силициды легко разлагаются водой или кислотами, при этом выделяется газообразное водородное соедине-ние кремния – силан: Mg2Si + 2H2SO4 = 2MgSO4 + SiH4

В отличие от углеводородов силан на воздухе самовоспламеняется и сгорает с образованием диоксида кремния и воды: SiH4 + 2O2 = SiO2 + 2H2O Повышенная реакционная способность силана по сравнению с метаном CH4 объясняется тем, что у кремния больше размер атома, чем у углерода, поэтому химические связи Si – H слабее связей C – H.

Химические свойства SiO2 Оксид кремния (IV) как и оксид углерода (IV) CO2 является кислотным оксидом. Однако в отличие от CO2 имеет не молекулярную, а атомную кристаллическую решётку. Поэтому SiO2 твёрдое и тугоплавкое вещество. Он не растворяется в воде и кислотах, кроме плавиковой кислоты HF, но взаимодействует при высоких температурах со щелочами с образованием солей кремниевой кислоты – силикатов: SiO2 + 2NaOH = Na2SiO3 + H2O t0 силикат натрия

Получение силикатов Силикаты можно получить сплавлением диоксида кремния с оксидами металлов или с карбонатами: SiO2 + CaO = CaSiO3 SiO2 + CaCO3 = CaSiO3 + CO2 Силикаты натрия и калия называют растворимым стеклом. Их водные растворы – это хорошо известный силикатный клей.

Получение кремниевой кислоты Из растворов силикатов действием на них более сильных кислот – соляной HCI, серной H2SO4, уксусной CH3COOH и даже угольной H2CO3: K2SiO3 + 2HCI = 2KCI + H2SiO3 Следовательно, кремниевая кислота очень слабая. Она нерастворима в воде и выпадает из реакционной смеси в виде студенистого осадка, похожую на студень, желе. При высыхании этой массы образуется высокопористое вещество – силикагель, применяемый как адсорбент – поглотитель других веществ.

Открытие кремния Хотя уже в глубокой древности люди широко использовали в своём быту соединения кремния, сам кремний в элементарном состоянии был впервые получен в 1825 г. шведским учёным Й. А. Берцелиусом. Однако за 12 лет до него кремний получили Ж. Гей-Люссак и Л. Тенар, но он был очень загрязнён примесями. Латинское название силициум кремний берёт своё начало от лат. силекс – кремень. Русское название «кремний» происходит от греч. кремнос – утёс, скала.

Получение кремния Получение кремния в промышленности: В промышленности кремний получают при нагревании смеси песка и угля: 2C + SiO2 Si + 2CO 0 +2 0 +4 4е Восстановленный кремний частично реагирует с избытком углерода, и образуется карборунд SiC (карбид кальция). Это очень твёрдое вещество и поэтому приме-няется для изготовления точильных и шлифовальных устройств.

2. Получение кремния в лаборатории: В лаборатории кремний получают при взаимодействии смеси чистого песка с порошком магния: 2Mg + SiO2 2MgO + Si 0 +4 +2 0 t0 4e Физические свойства кремния: Кристаллический кремний обладает металли-ческим блеском, тугоплавкий, очень твёрдый, с незначительной электрической проводимостью.
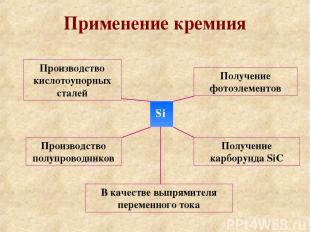
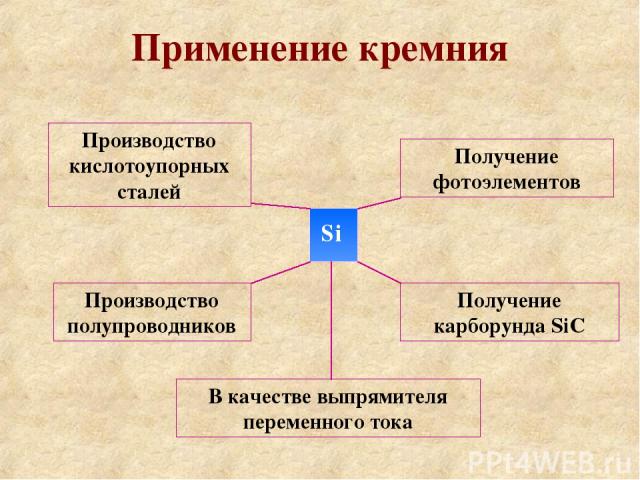
Применение кремния Si Производство кислотоупорных сталей Производство полупроводников Получение фотоэлементов Получение карборунда SiC В качестве выпрямителя переменного тока