Презентация на тему: Смещение химического равновесия

Обратимые реакции ХИМИЧЕСКОЕ РАВНОВЕСИЕ. Смещение равновесия 900igr.net

Цель урока формирование на межпредметном уровне представлений об обратимых реакциях, химическом равновесии, как динамическом состоянии системы, умений решать задачи по способам его смещения.

Задачи урока Образовательные: ознакомить учащихся с понятиями: обратимые реакции ,равновесие, равновесные концентрации, константа равновесия. Изучить факторы, влияющие на смещение равновесия.

Задачи урока Развивающие: совершенствовать интеллектуальные умения: выделять главное в рассказе учителя, развивать умения наблюдать, сравнивать, делать выводы из приведённых наблюдений, совершенствовать умение высказывать и обосновывать суждения, развивать навыки работы с химическими реактивами.

Задачи урока Воспитательные: воспитывать экологическую культуру: показать роль смещения равновесия в увеличении выхода продукта реакции в химической промышленности и как следствие уменьшение загрязнения окружающей среды. Воспитывать культуру речи и общения, трудолюбие, самостоятельность в выборе решения проблем.
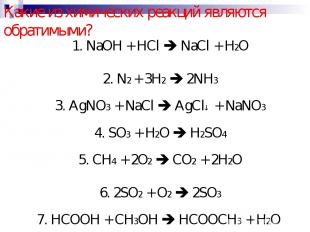
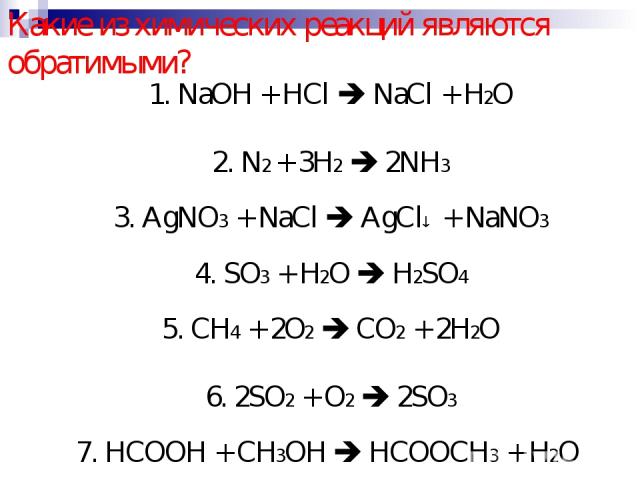
Какие из химических реакций являются обратимыми? 1. NaOH + HCl NaCl + H2O 2. N2 + 3H2 2NH3 3. AgNO3 + NaCl AgCl + NaNO3 4. SO3 + H2O H2SO4 5. CH4 + 2O2 CO2 + 2H2O 6. 2SO2 + O2 2SO3 7. HCOOH + CH3OH HCOOCH3 + H2O
По направленности процесса ОБРАТИМЫЕ НЕОБРАТИМЫЕ

НЕОБРАТИМЫЕ РЕАКЦИИ – ЭТО РЕАКЦИИ, ПРОТЕКАЮЩИЕ В ДАННЫХ УСЛОВИЯХ ТОЛЬКО В ОДНОМ НАПРАВЛЕНИИ. К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды) и все реакции горения

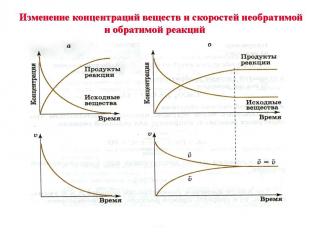
Обратимые реакции – это реакции, протекающие в данных условиях одновременно в двух противоположных направлениях Таких реакций подавляющее большинство. В органической химии признак обратимости отражают названия – антонимы процессов *Гидрирование – дегидрирование *Гидратация – дегидратация *Полимеризация – деполимеризация Обратимы все реакции этерификации (противоположный процесс носит название гидролиза)и гидролиза белков, сложных эфиров, углеводов, полинуклеотидов. Обратимость этих процессов лежит в основе важнейшего свойства живого организма – обмена веществ.

Равновеснные концентрации равновесие является динамическим, т.к. сколько молекул продукта прямой реакции образуется в единицу времени, столько их разлагается в единицу времени при протекании обратной реакции. При этих условиях концентрации всех реагирующих веществ остаются постоянными. Эти концентрации называются равновесными и обозначают их: [ Н2 ], [I2 ], [ НI ].

Обратимые реакции Н2+ I2 2НI 3H2 + N2 2NH3 + Q

Кинетические уравнения Согласно закону действующих масс кинетические уравнения имеют вид: Vпр= k 1 с (Н2) с (I2 ) Vоб = k 2 с 2 (НI)
![Костанта равновесия Для реакции аА + вВ сС + дД [c ]c .[д ] д К равн=----------- Костанта равновесия Для реакции аА + вВ сС + дД [c ]c .[д ] д К равн=-----------](https://fs3.ppt4web.ru/images/132073/183926/310/img13.jpg)
Костанта равновесия Для реакции аА + вВ сС + дД [c ]c .[д ] д К равн=----------------------- [А ]а .[В ] в

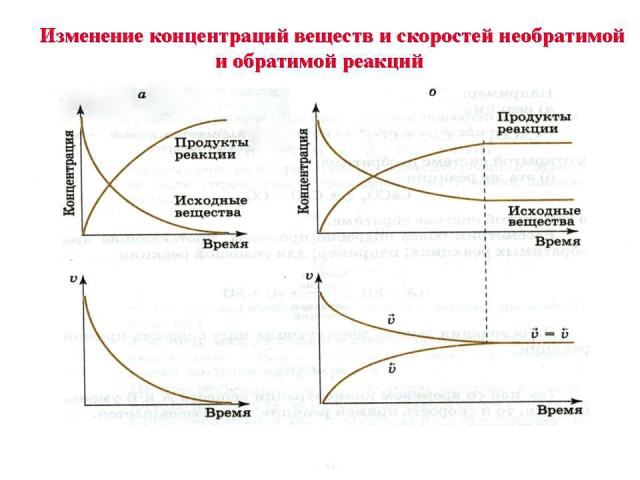
N 2 + 3 H2 2 NH3 прямая обратная Состояние системы, при котором скорость прямой реакции РАВНА скорости обратной реакции называется химическим равновесием график

СОСТОЯНИЕ РАВНОВЕСИЯ В ПРИРОДЕ Круговорот элементов и веществ в природе Уравновешены потоки энергии в экосистемах разного уровня УБЫЛЬ ОСОБЕЙ ЕСТЕСТВЕННЫЙ ПРИРОСТ Постоянство численности особей в популяции: ДИССИМИЛЯЦИЯ АССИМИЛЯЦИЯ Постоянство внутренней среды организма:

ПРИНЦИП ЛЕ ШАТЕЛЬЕ Если на систему, находящуюся в состоянии равновесия произвести внешнее воздействие (изменить давление, температуру, концентрацию), то равновесие сместится в сторону уменьшения данного воздействия (1884 год)

Анри Луи Ле Шателье (8. 10. 1850 – 17. 09. 1936) Французский физикохимик и металловед, член Парижской академии наук (с 1907). Родился в Париже. Учился в Политехнической школе и Высшей горной школе в Париже. Затем был горным инженером в Алжире и Безансоне. В 1878 – 1919 профессор Высшей горной школы. В 1907 – 1925 работал в Парижском университете. Исследования относятся к физической химии. Предложил оригинальный способ определения теплоемкостей газов при высоких температурах. Сформулировал (1884) общий закон смещения химического равновесия (принцип Ле Шателье). Изучал химические процессы в металлургии. Изучал свойства и способы приготовления цементов. Создал металлографический микроскоп и усовершенствовал методику исследования строения металлов и сплавов. Нашел условия синтеза аммиака. Президент Французского химического общества (1931). Иностранный член – корреспондент Петербургской академии наук (с 1913) и почетный член АН СССР (с 1926).
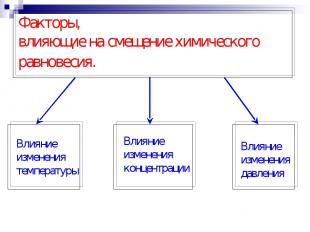
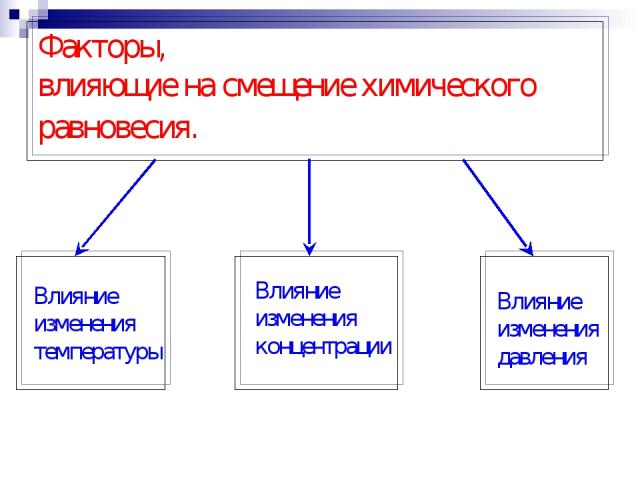
Факторы, влияющие на смещение химического равновесия.

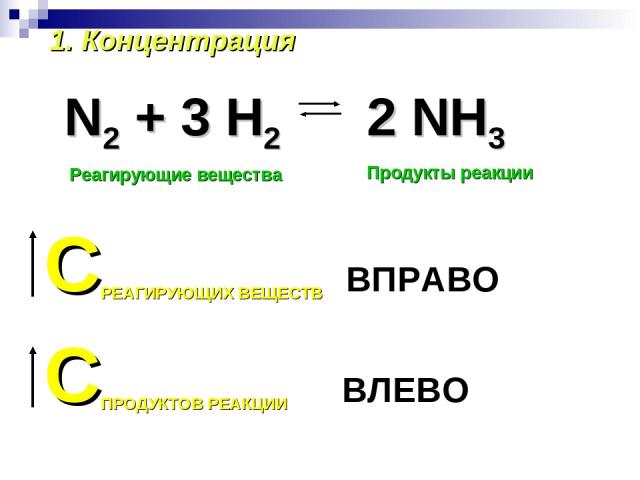
1. Концентрация N2 + 3 H2 Реагирующие вещества Продукты реакции СРЕАГИРУЮЩИХ ВЕЩЕСТВ ВПРАВО СПРОДУКТОВ РЕАКЦИИ ВЛЕВО 2 NH3

2. Температура эндотермическая реакция ( - Q ) экзотермическая реакция ( + Q ) N2 + 3 H2 +Q - Q t0c равновесие сместится влево t0c равновесие сместится вправо 2 NH3 + Q t0c = - Q t0c= + Q

3. Давление Давление применяется только для газов! N2(г) + 3 H2(г) 1V 3V 2V 4V Р равновесие сместится вправо Р равновесие сместится влево 2NH3(г) P - V P - V Объем твердых и жидких веществ равен нулю

В какую сторону сместится равновесие в обратимом процессе, уравнение которого 2 NO(г) + O2(г) 2 NO2(г) + Q , если вправо влево вправо А. увеличить давление Б. увеличить температуру В. Увеличить концентрацию кислорода
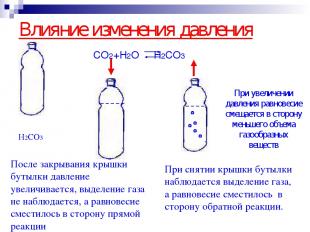
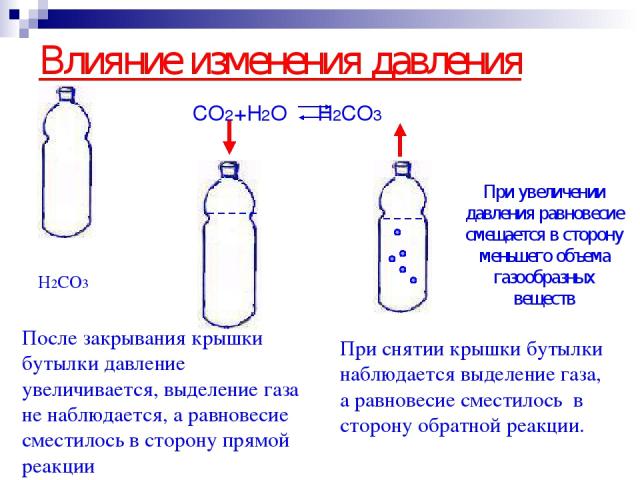
Влияние изменения давления CO2+H2O H2CO3 При снятии крышки бутылки наблюдается выделение газа, а равновесие сместилось в сторону обратной реакции. При увеличении давления равновесие смещается в сторону меньшего объема газообразных веществ H2CO3 После закрывания крышки бутылки давление увеличивается, выделение газа не наблюдается, а равновесие сместилось в сторону прямой реакции

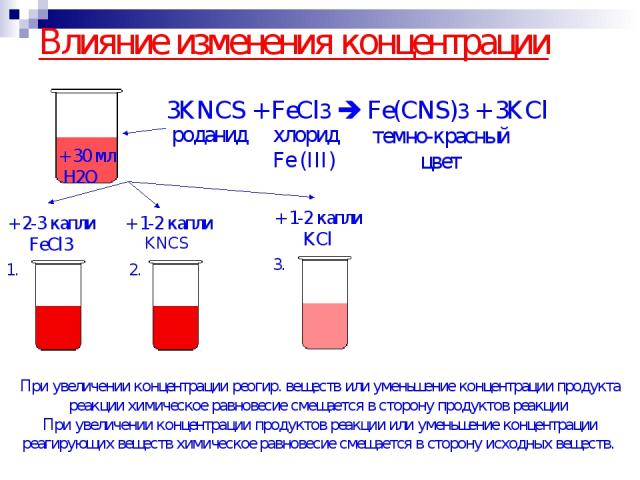
Влияние изменения концентрации + 2-3 капли FeCl3 + 1-2 капли KNCS + 1-2 капли KCl При увеличении концентрации реогир. веществ или уменьшение концентрации продукта реакции химическое равновесие смещается в сторону продуктов реакции При увеличении концентрации продуктов реакции или уменьшение концентрации реагирующих веществ химическое равновесие смещается в сторону исходных веществ.
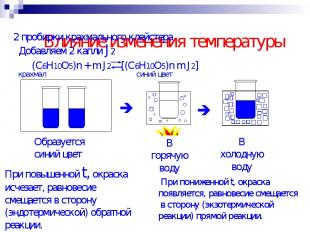
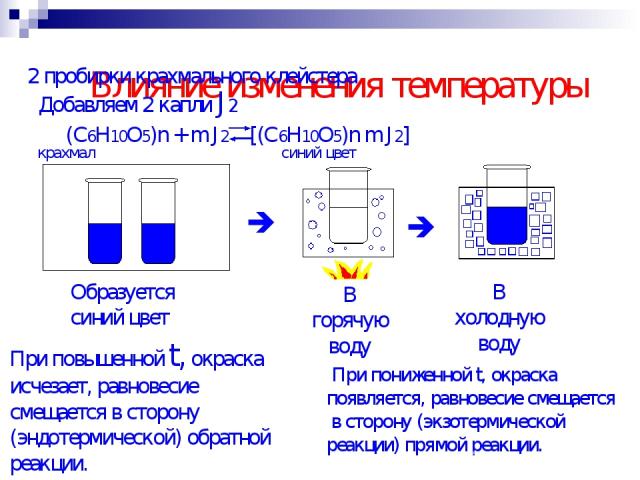
Влияние изменения температуры 2 пробирки крахмального клейстера Добавляем 2 капли J2 При повышенной t, окраска исчезает, равновесие смещается в сторону (эндотермической) обратной реакции. При пониженной t, окраска появляется, равновесие смещается в сторону (экзотермической реакции) прямой реакции.

Как известно, в воздухе содержится 21% кислорода (по массе). Такое количество необходимо для поддержания естественного равновесия: 3О2(г) 2O3(г) - Q. Классифицируйте данную реакцию. Какое значение имеет озон для планеты Земля? Используя принцип Ле Шателье предложите условия, при которых равновесие будет смещаться в сторону образования озона.

Принцип Ле Шателье широко используется в химической технологии для повышения выхода продукта производства. Согласуется ли процесс переноса кислорода в организме с принципом Ле Шателье (ответ обоснуйте)? Hb + O2 HbO2

Тесты I Репродуктивный уровень: тесты с альтернативными ответами, в которых испытуемый должен ответить да или нет. 1.Реакция горения фосфора- обратимая реакция ? а) да б) нет 2.Реакция разложения карбоната кальция- это обратимая реакция? а) да б) нет

Тесты с множественным выбором правильного ответа, при выполнении которых испытуемому необходимо выбрать 2 -3 правильных ответа, или сопоставить 2 предложенных условия при выборе ответа.

тесты * Тесты с выбором одного правильного ответа 6. В какой системе при повышении давления химическое равновесие сместится вправо? 1) 2HI(г)↔H2(г)+I2(г) 2) N2 + О2↔ 2 NО 3) C3 H6(г)+H2(г)↔С3 H8(г) 4) H2(г)+F2(г)↔2HF(г)

Тесты Тесты с множественным выбором правильного ответа, при выполнении которых испытуемому необходимо выбрать 2 -3 правильных ответа, или сопоставить 2 предложенных условия при выборе ответа.

тесты 16. Укажите верное суждение : А) в обратимых прцессах скорость прямой реакции в период от начала реакции до достижения равновесия уменьшается; Б) в обратимых процессах скорость прямой реакции после достижения равновесия равна нулю. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны

Рефлексия На уроке я работал активно / пассивно Своей работой на уроке я доволен/ недоволен Урок для меня показался коротким/ длинным За урок я устал/ не устал Моё настроение стало лучше/ стало хуже Материал урока мне был полезен/ бесполезен понятен/ не понятен лёгким / трудным Домашнее задание интересно/ не интересно











![Костанта равновесия Для реакции аА + вВ сС + дД [c ]c .[д ] д К равн=----------------------- [А ]а .[В ] в Костанта равновесия Для реакции аА + вВ сС + дД [c ]c .[д ] д К равн=----------------------- [А ]а .[В ] в](https://fs3.ppt4web.ru/images/132073/183926/640/img13.jpg)