Презентация на тему: СО2 углекислый газ

Выполнила Мамоян Жанна, 8 А класс 900igr.net

Доказать кислотный характер углекислого газа и изучить его биологическую роль 1)Исследовать водный раствор СО2; 2)Изучить взаимодействие углекислого газа со щелочью, оксидом кальция 3)Исследовать роль СО2 в фотосинтезе

Содержание Что такое диоксид углерода? Свойства Ход опытов Фотосинтез Парниковый эффект Вывод Список литературы.

Диоксид углерода Углекислый газ Другие названия углекислый газ, углекислота, сухой лед(твердый) Формула CO2 Молярная масса 44.0095(14) g/mol В твердом виде сухой лед Вид бесцветный газ Номер CAS [124-38-9]

Физические свойства Плотность и фазовое состояние 1600 кг/м³, твёрдый приблизительно 1.98 кг/м³, газ при н. У. Растворимость в воде 1.45 кг/м³ удельная теплота плавления 25.13 кДж/моль Точка плавления −57 °C (216 K), под давлением Точка кипения −78 °C (195 K), возгоняется Константа диссоциации кислоты (pKa) 6.35 and 10.33 Вязкость 0.07 пз при −78 °C
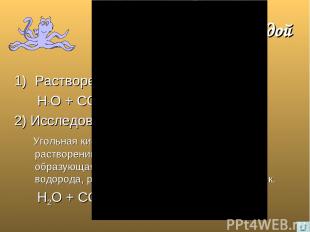
Взаимодействие с водой Растворение в воде; Н2О + СО2 = Н2СО3 2) Исследование индикатором; Угольная кислота – слабый электролит, при растворении в воде углекислого газа образующаяся кислота отщепляет один катион водорода, раствор приобретает розовый оттенок. Н2О + СО2 = Н+ + НСО3-

Реакция с основным оксидом СаО + СО2 = СаСО3 За время длительного хранения оксид кальция частично превратился в карбонат кальция, поэтому при добавлении кислоты мы видим выделение газа.

Реакция со щелочью СО2 + 2NаОН = Nа2СО3+Н2О В результате взаимодействия углекислого газа со щелочью в колбе образуется вакуум, поэтому яйцо затягивается внутрь.

Обнаружение углекислого газа Са(ОН)2 + СО2 СаСО3 + Н2О При пропускании СО2 через известковую воду выпадает осадок (карбонат кальция), при этом раствор мутнеет.

Фотосинтез ФОТОСИНТЕЗ (от фото... и синтез), уникальный физико-химический процесс, осуществляемый на Земле всеми зелеными растениями и некоторыми бактериями на свету

Фотосинтез Известно, что фотосинтез идет с максимальной скоростью, если растение обеспечено водой, углекислотой и светом. А вот углекислого газа в воздухе немного – всего 0,03 %. Увеличить его концентрацию, например, в теплицах можно разными способами. Например, в теплицы подают газы, которые выходят из котельной. Концентрация СО2 увеличивается в 10 – 15 раз, при этом с квадратного метра грядки получают дополнительно 2 кг помидоров или 5 кг огурцов. 6СО2 + 6Н2О С6Н12О6 + 6О2

ПАРНИКОВЫЙ ЭФФЕКТ - нагрев внутренних слоев атмосферы, обусловленный прозрачностью атмосферы для основной части излучения Солнца и поглощением атмосферой основной части теплового излучения поверхности планеты, нагретой Солнцем. В атмосфере Земли излучение поглощается молекулами Н2О, СО2, О3и др. Парниковый эффект повышает среднюю температуру планеты, смягчает различия между дневными и ночными температурами. В результате антропогенных воздействий содержание СО2 в атмосфере Земли постепенно возрастает. Не исключено, что усиление парникового эффекта в результате этого процесса может привести к глобальным изменениям климата Земли. Парниковый эффект

Выводы: Действительно, углекислый газ – оксид с кислотным характером Углекислый газ – важнейший участник процесса фотосинтеза Содержание углекислого газа в атмосфере влияет на климат Земли

Список литературы. Сайты в интернете: www.wikipedia.ru www.krugosvet.ru www.nature.web.ru Химия Ф.Г.Фельдман 9 класс, издательство «Просвещение»1996год. Научно-популярный журнал «Химия и жизнь»




![Диоксид углерода Углекислый газ Другие названия углекислый газ, углекислота, сухой лед(твердый) Формула CO2 Молярная масса 44.0095(14) g/mol В твердом виде сухой лед Вид бесцветный газ Номер CAS [124-38-9] Диоксид углерода Углекислый газ Другие названия углекислый газ, углекислота, сухой лед(твердый) Формула CO2 Молярная масса 44.0095(14) g/mol В твердом виде сухой лед Вид бесцветный газ Номер CAS [124-38-9]](https://fs3.ppt4web.ru/images/132073/183927/640/img3.jpg)





















